
- DAZ.online
- News
- Politik
- Das sind die neuen EU-...
Europäisches Parlament
Das sind die neuen EU-Regeln für Medizinprodukte
Berlin - 05.04.2017, 16:27 Uhr
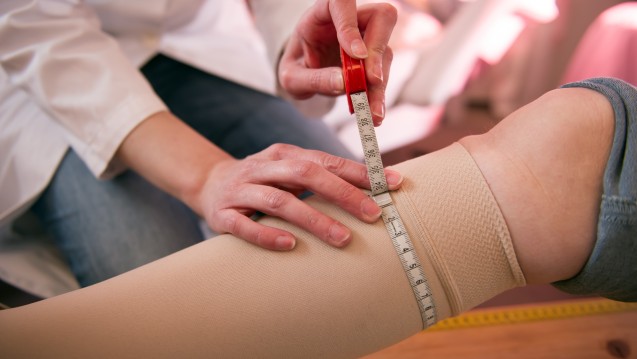
Endlich geregelt: Nach langwierigen Verhandlungen hat das EU-Parlament am heutigen Mittwoch neue Regulierungen für Medizinprodukte beschlossen. (Foto: fotolia/Klick61)
Rechtsrahmen war überholt
Der derzeit geltende Rechtsrahmen stammt aus den 1990er-Jahren. Er besteht aus drei Richtlinien, die nun durch zwei EU-Verordnungen abgelöst werden. Probleme aufgrund abweichender Auslegungen und Anwendung der Vorschriften, der technische Fortschritt und Vorfälle durch fehlerhafte Medizinprodukte, allem voran der Skandal um die Brustimplantate, hatten eine Überarbeitung dringend nötig gemacht. Im September 2012 hatte die Kommission schließlich zwei Legislativvorschläge zu Medizinprodukten und zu In-vitro-Diagnostika vorgelegt. Mehr als viereinhalb Jahre brauchte es für die Verabschiedung.
Starke Belastung für KMUs
Die Industrie spricht überwiegend von recht guten Kompromissen – es hätte auch noch schlimmer kommen können –, sieht aber teilweise eine Lawine von neuen und erhöhten Anforderungen auf sich zukommen. Nach Ansicht des Bundesverbandes Medizintechnologie (BVMed) werden die neuen Vorschriften besonders kleine und mittelständische Unternehmen zusätzlich stark belasten. Der BVMed will sich deshalb für ein nationales Förderprogramm für MedTech-KMUs einsetzen.
Experten befürchten Engpässe bei den Benannten Stellen
Auch die Behörden haben bei Fachveranstaltungen in den letzten Monaten immer wieder eine gewisse Besorgnis zum Ausdruck gebracht, ob und wie die Regeln in dem vorgegebenen Zeitraum umgesetzt werden können. Besonders hart trifft es die Benannten Stellen, die für die Zertifizierung von Medizinprodukten zuständig sind. Sie müssen sich einem neuerlichen Legitimierungsprozess unterziehen. Experten befürchten, dass es hierdurch bei bestimmten Produkten, wie etwa den stofflichen Medizinprodukten, die auch in der Apotheke eine Rolle spielen könnten, zu Engpässen bei der Marktgenehmigung kommen könnte.
Umsetzung dauert noch
Jetzt heißt es aber erst mal „Durchatmen“. Die neuen Vorschriften gelten im Fall der Verordnung über Medizinprodukte erst drei Jahre und im Fall der Verordnung über In-vitro-Diagnostika fünf Jahre nach Veröffentlichung im Amtsblatt der EU, die noch in diesem Monat erfolgen könnte. Teilweise werden die Regelungen auch erst viel später in die Praxis umgesetzt, weil zunächst die entsprechenden Funktionalitäten geschaffen werden müssen. Außerdem wird die Verordnung über Medizinprodukte (MDR) durch 32 neue durchführende und weitere elf delegierte Rechtsakte ergänzt, deren Erarbeitung noch bevorsteht. Das Ende der „regulatorischen Fahnenstange“ für Medizinproduke ist demnach noch lange nicht abzusehen.


























1 Kommentar
.....neuen EU-Regeln für Medizinprodukte
von Gerhard Borchers am 06.04.2017 um 8:46 Uhr
» Auf diesen Kommentar antworten | 0 Antworten
Das Kommentieren ist aktuell nicht möglich.