
- DAZ.online
- News
- Zertifizierungsengpass ...
Stoffliche Medizinprodukte
Zertifizierungsengpass bei Meerwassernasensprays und Co. befürchtet
Bonn - 25.01.2017, 16:00 Uhr

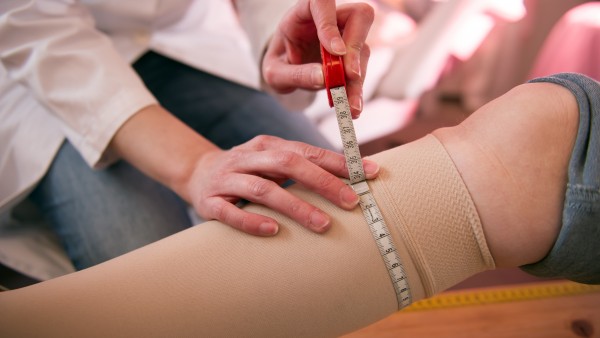
Auch salzhaltige Nasensprays sind sogenannte stoffliche Medizinprodukte, die zertifiziert werden müssen. (Foto: arborpulchra / Fotolia)
Die Verfügbarkeit Benannter Stellen könnte sich in Zukunft zu einem ernsten Problem für die Zertifizierung stofflicher Medizinprodukte, wie bestimmte Abführmittel, Heilerden oder Meerwasser-Nasensprays, entwickeln. Davor warnte der Bundesverband der Arzneimittel-Hersteller (BAH) bei einer Informationsveranstaltung am heutigen Mittwoch in Bonn.
Stoffliche Medizinprodukte ähneln vom Erscheinungsbild her Arzneimitteln. Im Gegensatz zu diesen wirken sie aber nicht pharmakologisch, metabolisch oder immunologisch, sondern physikalisch oder physikochemisch. Dazu gehören zum Beispiel bestimmte Abführmittel, Heilerden und Meerwasser-Nasensprays.
Mit der neuen EU-Verordnung über Medizinprodukte (MDR) müssen stoffliche Medizinproduke in Zukunft von einer Benannten Stelle zertifiziert werden. Außerdem müssen die Hersteller Wirksamkeitsnachweise und Studien zur Sicherheit vorlegen. Sie werden in höhere Risikoklassen umgestuft und damit zum Teil auf eine Stufe zum Beispiel mit Produkten wie Herzschrittmachern gestellt. Die Risikoklassifikation, die die Kriterien für den Marktzugang im Einzelnen bestimmt, wird nach den Kriterien Ort der Anwendung, Absorption und Verwendungszweck vorgenommen werden.
Guter Kompromiss gefunden
Die Bedeutung der stofflichen Medizinprodukte war im frühen Gesetzgebungsverfahren für das neue Medizinprodukterecht zunächst nicht gebührend erkannt worden. „Das Verständnis für diese Kategorie ist erst durch die intensiven Diskussionen in den letzten Jahren gewachsen“, hatte der Generaldirektor des Europäischen Dachverbandes für die Selbstmedikation AESGP Hubertus Cranz beim BAH im Dialog Ende September 2016 in Berlin betont. Im Vergleich zu den ersten Überlegungen der EU-Kommission, sie komplett aus dem Medizinprodukterecht herauszunehmen, konnte nun nach allgemeiner Einschätzung ein sachgerechter Kompromiss gefunden werden.
Mit der neuen Verordnung über Medizinprodukte bekennt sich der Gesetzgeber erstmals klar dazu, dass solche Produkte überhaupt existieren. In den Diskussionen um die MDR war zum Teil sogar der komplette Ausschluss der Produktkategorie aus dem Anwendungsbereich des Medizinprodukterechts gefordert worden. Trotzdem sind vor allem die kleinen und mittelständischen Unternehmen von den Neuerungen stark betroffen. Sie müssen nun ihr Portfolio sichten, um die zukunftsträchtigsten Produkte herauszufiltern, für die sich der anstehende Aufwand rechnet. Dann müsste für diese eine passende Benannte Stelle zur Zertifizierung gesucht werden, wobei es unter Umständen Probleme geben könne.


























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.