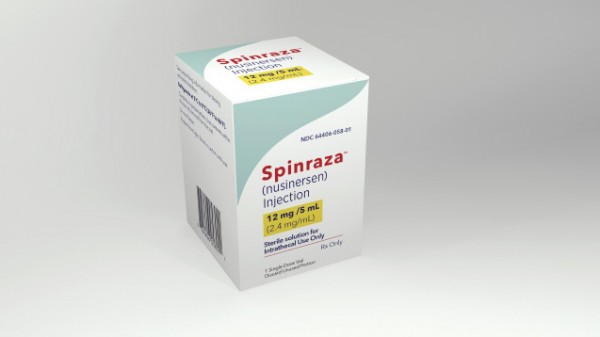
Als die US-amerikanischen Pharmafirmen Biogen und Ionis
Pharmaceuticals Anfang des Monats einen Erfolg mit ihrem Arzneimittel Nusinersen®
bekannt gaben, schöpften viele Patienten mit Spinaler Muskelatrophie (SMA) Hoffnung:
Bisher gibt es keine Therapie für ihre Erkrankung, die mit teils
schwerwiegenden Behinderungen einhergeht. Wie die Firmen in einer
Presseerklärung mitteilten, ergab eine Zwischenanalyse, dass Nusinersen bei
Säuglingen mit dem besonders schweren SMA-Typ-1 eine Wirkung gezeigt hat.
Bislang sterben die von diesem Typ betroffenen Kinder oft im Alter von ein oder zwei
Jahren, da ein Defekt im Gen SMN1 zu einem Defekt der Motoneurone im Rückenmark
und zu einer Abnahme der Muskelkraft führt.
Biogen gab bisher nur bekannt, dass in der 13-monatigen
Studie mit 122 Patienten im Alter von höchstens sieben Monaten bei Gabe von
Nusinersen Verbesserungen der Motorik beobachtet wurden. Die genauen Daten
sollen in den nächsten Wochen auf internationalen Konferenzen bekannt gegeben
werden. In der „ENDEAR“-Studie sei der Anteil der Patienten mit Typ1-SMA, die motorische
Verbesserungen zeigten, in der Wirkstoffgruppe signifikant größer gewesen als
in der Placebo-Gruppe, erklärte Biogen.
Ersatz für das fehlende Protein
„Wir sind hoffnungsvoll, dass Nusinersen – wenn zugelassen –
einen bedeutsamen Unterschied im Leben der Patienten und Familien macht, die
von SMA betroffen sind“, erklärte Ionis-Geschäftsführer B. Lynne Parshall. „Wir
freuen uns, mit Biogen daran zu arbeiten, das klinische Programm
fertigzustellen und ein hoffentlich positives Zulassungsverfahren vorzubereiten.“
Bei Nusinersen handelt es sich um ein Antisense-Oligonukleotid.
Die kurze Nukleotid-Sequenz beeinflusst die Produktion des benötigten SMN-Proteins,
indem das Gen SMN2 vermehrt exprimiert wird. Dieses ist dem bei SMA-Patienten fehlenden
oder mutierten SMN1-Gen sehr ähnlich. Forscher hoffen, dass auf diesem Weg das
lebenswichtige Protein ersetzt werden kann. Die Verabreichung von Nusinersen
ist vergleichsweise aufwändig, denn es muss über eine Lumbalpunktion direkt in
das Hirnwasser gespritzt werden. Nach einer ersten Behandlung erfolgen
Wiederholungen nach 14, 30 und 60 Tagen – anschließend alle vier Monate.
Auch nachdem die Studie bei Kindern mit Typ-1-SMA vorzeitig beendet
wurde, laufen drei weitere Studien mit Nusinersen zum Einsatz bei älteren oder
jüngeren Patienten in der ENDEAR-Studie noch weiter. Biogen gab bekannt,
dass es an einem Compassionate-Use-Programm arbeite, über das Patienten möglicherweise
schon vor der Zulassung Nusinersen erhalten könnten. „Wir teilen das Gefühl der
Dringlichkeit der Betroffenen, während wir danach streben, Familien die erste Behandlung
für SMA, der führenden genetischen Ursache für Kindersterblichkeit, zur
Verfügung zu stellen“, erklärte Alfred Sandrock, Vizepräsident von Biogen.






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.