
- DAZ.online
- News
- Pharmazie
- Erster Erfolg bei ...
Spinale Muskelatrophie
Erster Erfolg bei Arzneimittel für Muskelerkrankung
Stuttgart - 23.08.2016, 17:00 Uhr
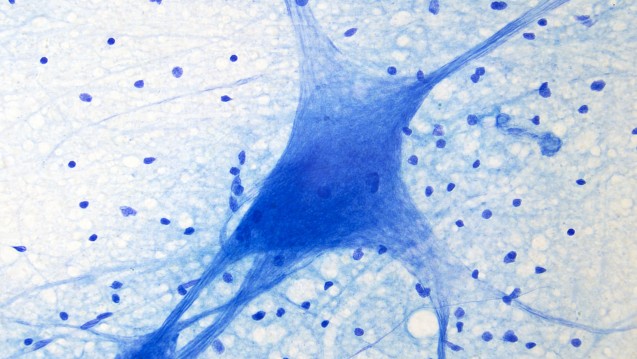
Bei Patienten mit Spinaler Muskelatrophie bilden sich bestimmte Nervenzellen im Rückenmark zurück, was zu einer Schwächung von Muskeln führt. (Foto: psdesign1 / Fotolia)
Für Patienten mit Spinaler Muskelatrophie gibt es bislang kein wirksames Arzneimittel, bei schwerem Verlauf versterben viele Kinder früh. Pharmahersteller Ionis brach nun aufgrund guter Ergebnisse eine Phase-3-Studie vorzeitig ab. Deutsche Experten hoffen, dass einem Teil der Patienten etwas geholfen werden kann – warnen aber auch vor zuviel Optimismus.
Als die US-amerikanischen Pharmafirmen Biogen und Ionis Pharmaceuticals Anfang des Monats einen Erfolg mit ihrem Arzneimittel Nusinersen® bekannt gaben, schöpften viele Patienten mit Spinaler Muskelatrophie (SMA) Hoffnung: Bisher gibt es keine Therapie für ihre Erkrankung, die mit teils schwerwiegenden Behinderungen einhergeht. Wie die Firmen in einer Presseerklärung mitteilten, ergab eine Zwischenanalyse, dass Nusinersen bei Säuglingen mit dem besonders schweren SMA-Typ-1 eine Wirkung gezeigt hat. Bislang sterben die von diesem Typ betroffenen Kinder oft im Alter von ein oder zwei Jahren, da ein Defekt im Gen SMN1 zu einem Defekt der Motoneurone im Rückenmark und zu einer Abnahme der Muskelkraft führt.
Biogen gab bisher nur bekannt, dass in der 13-monatigen Studie mit 122 Patienten im Alter von höchstens sieben Monaten bei Gabe von Nusinersen Verbesserungen der Motorik beobachtet wurden. Die genauen Daten sollen in den nächsten Wochen auf internationalen Konferenzen bekannt gegeben werden. In der „ENDEAR“-Studie sei der Anteil der Patienten mit Typ1-SMA, die motorische Verbesserungen zeigten, in der Wirkstoffgruppe signifikant größer gewesen als in der Placebo-Gruppe, erklärte Biogen.
Ersatz für das fehlende Protein
„Wir sind hoffnungsvoll, dass Nusinersen – wenn zugelassen – einen bedeutsamen Unterschied im Leben der Patienten und Familien macht, die von SMA betroffen sind“, erklärte Ionis-Geschäftsführer B. Lynne Parshall. „Wir freuen uns, mit Biogen daran zu arbeiten, das klinische Programm fertigzustellen und ein hoffentlich positives Zulassungsverfahren vorzubereiten.“
Bei Nusinersen handelt es sich um ein Antisense-Oligonukleotid. Die kurze Nukleotid-Sequenz beeinflusst die Produktion des benötigten SMN-Proteins, indem das Gen SMN2 vermehrt exprimiert wird. Dieses ist dem bei SMA-Patienten fehlenden oder mutierten SMN1-Gen sehr ähnlich. Forscher hoffen, dass auf diesem Weg das lebenswichtige Protein ersetzt werden kann. Die Verabreichung von Nusinersen ist vergleichsweise aufwändig, denn es muss über eine Lumbalpunktion direkt in das Hirnwasser gespritzt werden. Nach einer ersten Behandlung erfolgen Wiederholungen nach 14, 30 und 60 Tagen – anschließend alle vier Monate.
Auch nachdem die Studie bei Kindern mit Typ-1-SMA vorzeitig beendet wurde, laufen drei weitere Studien mit Nusinersen zum Einsatz bei älteren oder jüngeren Patienten in der ENDEAR-Studie noch weiter. Biogen gab bekannt, dass es an einem Compassionate-Use-Programm arbeite, über das Patienten möglicherweise schon vor der Zulassung Nusinersen erhalten könnten. „Wir teilen das Gefühl der Dringlichkeit der Betroffenen, während wir danach streben, Familien die erste Behandlung für SMA, der führenden genetischen Ursache für Kindersterblichkeit, zur Verfügung zu stellen“, erklärte Alfred Sandrock, Vizepräsident von Biogen.






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.