
- DAZ.online
- News
- Recht
- Der spirituelle Weise und...
Marciej Szpunar zu Defekturarzneimitteln
Der spirituelle Weise und der EuGH-Anwalt
Berlin - 08.07.2016, 16:45 Uhr

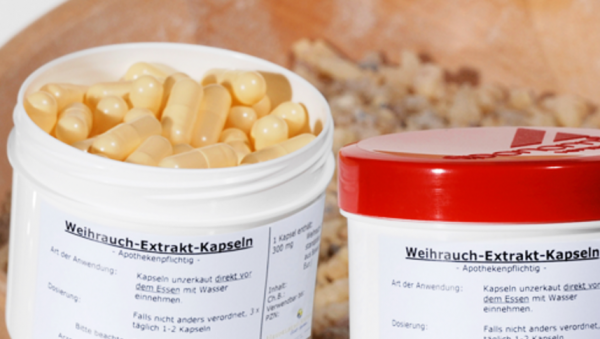
Defektur-Arzneimittel bedürfen keiner Zulassung. Sind sie verschreibungsfrei, ist eine Werbung für sie möglich - meint EuGH-Generalanwalt Marciej Szpunar. (Foto: Kadmy / Fotolia)
Dass in Deutschland Defekturarzneimittel von der Zulassungspflicht freigestellt sind, steht aus Sicht des EuGH-Generalanwalts Marciej Szpunar im Einklang mit Europäischem Gemeinschaftsrecht. Wird der Gerichtshof seiner apothekenfreundlichen Einschätzung folgen?
„Die spirituellen und therapeutischen Eigenschaften des Weihrauchs sowie seine Geruchsmerkmale haben Europa fasziniert, seit ihn einer der Weisen, Melchior, aus seiner Heimat Arabien lieferte“ – geradezu märchenhaft steigt der Generalanwalt am Europäischen Gerichtshof (EuGH) Marciej Szpunar in seine neuesten Schlussanträge ein, die sich mit dem deutschen Recht rund um die Apotheke befassen. „Der vorliegende Fall, in dem eine deutsche Apotheke Weihrauchkapseln herstellt und an Patienten an Ort und Stelle verkauft, bildet da keine Ausnahme, auch wenn der Sachverhalt gegenüber der Suche der Drei Weisen eher profan ist“, schreibt er weiter.
Bereits in seinen umstrittenen Schlussanträgen zum deutschen Rx-Boni-Verbot für ausländische Versandapotheken zeigte sich der polnische Generalanwalt als Freund launiger Formulierungen. Allerdings sind Szpunars Ausführungen zur Defektur letztlich apothekenfreundlicher als diese. Hier geht es schließlich um ein Privileg für Apotheken: Nur sie dürfen – in begrenztem Umfang und unter besonderen Voraussetzungen – Arzneimittel selbst herstellen und sie ohne gesonderte Zulassung vertreiben.
Hecht-Pharma klagt
Worum geht es im konkreten Fall? Die Firma Hecht-Pharma, die Weihrauchkapseln als Nahrungsergänzungsmittel vertreibt, hat gegen einen Apotheker geklagt, der selbige als Arzneimittel herstellt und vertreibt. Eine arzneimittelrechtliche Zulassung besitzt er nicht. Im Jahr 2015 gab der Apotheker 213 Packungen seiner Kapseln ab. Hecht-Pharma wollte dem Apotheker verbieten lassen, über entsprechende „Patienteninformationen“ und Broschüren für seine Weihrauchkapseln zu werben. Ob Hecht-Pharma damit durchkommt, hängt davon ab, ob die Weihrauchkapseln als Arzneimittel zulassungspflichtig sind. Denn nach dem Heilmittelwerbegesetz ist eine Werbung für zulassungspflichtige Arzneimittel, die nicht nach den arzneimittelrechtlichen Vorschriften zugelassen sind oder als zugelassen gelten, unzulässig. Der beklagte Apotheker ist jedoch überzeugt, dass die von ihm beworbenen „Weihrauch-Extrakt-Kapseln“ als Defekturarzneimittel (§ 21 Abs. 2 Nr. 1 AMG) keiner Zulassung bedürfen.
In den ersten beiden ersten Instanzen blieb die Klage von Hecht-Pharma erfolglos. Doch das Unternehmen zog bis zum Bundesgerichtshof. Und hier war man bereit, den EuGH anzurufen. Die Karlsruher Richter haben ihren Kollegen in Luxemburg die Frage vorgelegt, ob die in § 21 Abs. 2 Nr. 1 AMG geregelte Ausnahme von der generellen Zulassungspflicht mit dem Gemeinschaftskodex für Humanarzneimittel (EU-Richtlinie 2001/83) vereinbar ist.
Defektur – kein Fall für den Arzneimittelkodex
Der zuständige Generalanwalt erklärt nun in seinen Schlussanträgen, dass Defekturarzneimittel seiner Meinung nach gar nicht unter den Arzneimittelkodex fallen. Besagte Richtlinie gilt nach ihrem Art. 2 Abs. 1 für Humanarzneimittel, „die entweder gewerblich zubereitet werden oder bei deren Zubereitung ein industrielles Verfahren zur Anwendung kommt“. Diese Begriffe sind in der Richtlinie nicht definiert. Doch Szpunar verweist auf ein anderes EuGH-Urteil, aus dem er letztlich ableitet, dass die Weihrauch-Kapseln des Apothekers, die handwerklich und nicht in bedeutender Menge hergestellt werden, diese Voraussetzungen nicht erfüllen. Daher würde er die Prüfung hier bereits abschließen.
Für den Fall, dass der Gerichtshof dies anders sehen sollte, prüft der Generalanwalt vorsorglich aber auch Normen des Arzneimittelkodex, nach denen die Anwendung der Richtlinie ausgeschlossen sein kann. Einzig denkbar ist für ihn Art. 3 Nr. 2. Danach gilt die Richtlinie nicht für „in der Apotheke nach Vorschrift einer Pharmakopöe zubereitete Arzneimittel, die für die unmittelbare Abgabe an die Patienten bestimmt sind, die Kunden dieser Apotheke sind (sogenannte formula officinalis)“.
Was heißt „nach Vorschrift einer
Pharmakopöe“?
Fraglich sei hier allein das Tatbestandsmerkmal „nach Vorschrift einer Pharmakopöe“. Der Bundesgerichtshof hatte hier Zweifel an der europarechtlichen Konformität des § 21 Abs. 2 Nr. 1 AMG, weil dieser nicht verlangt, dass das in einer Apotheke hergestellte Arzneimittel nach Vorschrift einer Pharmakopöe hergestellt wurde.
Doch auch hier kommt Szpunar im vorliegenden Fall zu dem Ergebnis, dass der Apotheker zumindest die Vorgaben des Europäischen Arzneibuchs eingehalten habe. Dies reicht ihm dafür, dass die Voraussetzungen des Art. 3 Nr. 2 der Richtlinie 2001/83 erfüllt sind.
Ob die angeführte deutsche Bestimmung auch ganz allgemein mit Art. 3 Nr. 2 im Einklang steht, beantwortet Szpunar ebenso. Das Tatbestandsmerkmal „nach Vorschrift einer Pharmakopöe“ sei eng nach seinem Wortlaut auszulegen, insbesondere deshalb, weil es hier um eine Ausnahme von einer allgemeinen Regel gehe. Es bedeute, dass eine solche Vorschrift, sofern sie existiert, zwingend zu befolgen ist.
„Falls eine solche Vorschrift nicht existiert, fiele es mir schwer, hinzunehmen, dass auf diese Anforderung an Erzeugnisse, nämlich dass sie ‚gewerblich zubereitet werden oder bei deren Zubereitung ein industrielles Verfahren zur Anwendung kommt‘, einfach verzichtet werden kann, um sie nach Art. 3 der Richtlinie 2001/83 von deren Anwendungsgebiet auszunehmen“.
Nun heißt es abwarten, wie der Gerichtshof den Fall bewertet. Die Schlussanträge sind für ihn nicht bindend. Werden sich die Richter vielleicht den spirituellen Eigenschaften des Weirauchs anvertrauen, um zu einer angemessenen Entscheidung zu kommen?
Hier finden Sie die Schlussanträge des Generalanwalts im Wortlaut.

























1 Kommentar
Gericht
von Florian Becker am 12.07.2016 um 8:55 Uhr
» Auf diesen Kommentar antworten | 0 Antworten
Das Kommentieren ist aktuell nicht möglich.