
- DAZ.online
- News
- Neue Listen, neue ...
DAZ.online-Wochenschau
Neue Listen, neue Verordnungen, neue Rezepte, neue Arzneimittel
Bestimmt würde sich jeder zur Zeit lieber mit Listen an den Weihnachtsmann beschäftigen. Doch die Substitutionsausschlussliste und die Liste zu den ruhenden Zulassungen dominieren den Alltag. Aber in der vergangene Woche passierte noch mehr, wie Sie in unserer Wochenschau lesen können ...
Listen über Listen: Die Substitutionsausschlussliste gilt zwar seit dem 10. Dezember – die Apotheken-Software zeigt allerdings noch nicht an, dass Präparate mit entsprechenden Wirkstoffen nicht mehr ausgetauscht werden dürfen. Die ABDA geht davon aus, dass die Liste ab dem 1. Januar in der Software abgebildet sein wird. Um die Apotheker in diesem Zeitraum zu unterstützen, hat das DeutscheApothekenPortal (DAP) eine 18-seitige Liste mit knapp 700 Positionen mit Arzneimitteln erarbeitet, für die ein Austauschverbot besteht.
Kein Retax bei Abgabe eines Rabattarzneimittels. Die Substitutionsausschlussliste sorgt vor für Trubel. Geduld ist gefragt – und Zuversicht, dass die Krankenkassen am Ende nicht doch einen Grund zur Retaxation finden. Nachdem die AOK Baden-Württemberg bereits erklärt hat, sie werde es jedenfalls nicht beanstanden, wenn Apotheken AOK-Versicherte mit rabattierten Arzneimitteln weiterversorgen, zieht nun auch die Techniker Krankenkasse (TK) nach.
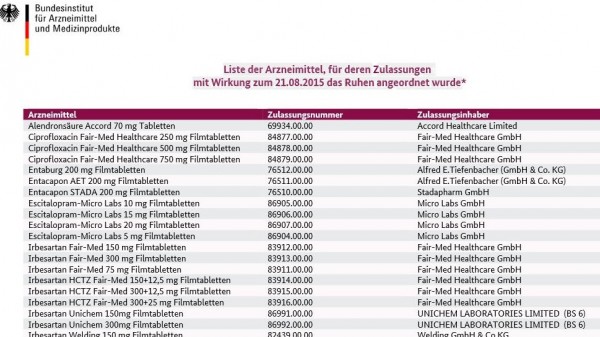
Liste mit ruhenden Zulassungen. Das BfArM aktualisiert (manchmal mehrmals) täglich auf seine Seiten die Liste, bei denen wegen invalider Studiendaten ein Ruhen der Zulassung angeordnet wurde. Kritisiert wird die unprofessionelle Informationsaufarbeitung durch das BfArM. Zulassungen ruhen, Hersteller widersprechen oder rufen zurück, Produkte werden nicht mehr aufgeführt und sind wieder erhältlich. Vermisst wird unter anderem eine chronologische Liste der Änderungen. Das DAP hat nun die aktualisierte BfArM-Liste zur Grundlage seiner neuen, in drei Teile gegliederten PZN-Liste genommen. Die Liste 1 beinhaltet eine Aufstellung der nicht verkehrsfähigen Arzneimittel mit PZN. In Liste 2 werden die nach eingelegtem Widerspruch des Herstellers vorläufig wieder verkehrsfähigen Präparate aufgeführt. Und in der dritten Liste finden sich Arzneimittel mit ruhender Zulassung ohne PZN. Diese sind zwar für den deutschen Markt zugelassen, sind aber in Deutschland nicht in Vertrieb.
Nur noch neue BtM-Rezepte. Die Opiumstelle im BfArM gibt seit März vergangenen Jahres neue Betäubungsmittelrezepte aus. Die alten BtM-Rezepte sind lediglich bis zum 31. Dezember 2014 gültig – ab dem 1. Januar 2015 dürfen Ärzte daher nur noch auf dem neuen Formular Betäubungsmittel verschreiben. Folglich dürfen Apotheken ab dem 8. Januar 2015 nur noch neue Betäubungsmittelrezepte beliefern.
Neue Kennzeichnungspflichten. Seit dem 13. Dezember 2014 gilt die Lebensmittel-Informationsverordnung (LMIV). Für Apotheken mit Versandhandelserlaubnis ist wichtig: Werden Lebensmittel – darunter fallen auch Nahrungsergänzungsmittel – „durch Einsatz von Fernkommunikationstechniken zum Verkauf angeboten“, müssen die verpflichtenden Informationen über Lebensmittel - mit Ausnahme des Mindesthaltbarkeitsdatums oder des Verbrauchsdatums – vor dem Abschluss des Kaufvertrags verfügbar sein. Auf der Webseite einer Versandapotheke müssen die nötigen Angaben vermerkt sein. Fehlen die Angaben, könnten Abmahnungen drohen.
T-Rezepte jetzt wöchentlich ans BfArM. In der letzten Sitzung dieses Jahres hat der Bundesrat eine Änderungsverordnung beschlossen, mit der mehrere Verordnungen geändert werden, die den Vertriebsweg von Arzneimitteln und Medizinprodukte betreffen. So soll die verschreibende Person auf Rezepten, die in Deutschland eingelöst werden sollen, künftig eine Telefonnummer zur Kontaktaufnahme anzugeben hat. Ferner haben Apotheken die Durchschriften von T-Rezepten künftig wöchentlich statt bisher vierteljährlich an das BfArM zu übermitteln. Chinin zur Anwendung beim Menschen wird vollständig der Verschreibungspflicht unterstellt.
Lagerwertverluste drohen! Zum 1. Januar 2015 treten für vier Wirkstoffe neue Festbeträge in Kraft. Je nach Reaktion des Arzneimittelherstellers kann dies im neuen Jahr zu erheblichen Mehrkosten bei den Patienten oder am Jahreswechsel zu Lagerwertverlusten bei den Apotheken führen. Der GKV-Spitzenverband hat zum 1. Januar neue Festbeträge der Stufe 1 (Arzneimittel mit demselben Wirkstoff) für Clopidogrel, Hydromorphon, Montelukast und Pramipexol festgesetzt.
Bupropion + Naltrexon zum Abnehmen. Die EMA hat in ihrer letzten Sitzung in diesem Jahr eine Zulassungsempfehlung für die Kombination aus dem Antidepressivum Bupropion und dem Opiat-Antagonisten Naltrexon (Mysimba®) zur Gewichtsreduktion ausgesprochen.
Viele neue Wirkstoffe 2014. 49 Arzneimittel mit neuen Wirkstoffen sind 2014 auf den Markt gekommen. Darunter elf gegen Infektionskrankheiten – allein vier gegen Hepatitis C – und acht gegen Krebserkrankungen. Der Verband forschender Pharma-Unternehmen (vfa) ist zufrieden mit der Entwicklung – so viele neue Medikamente seien seit 25 Jahren nicht eingeführt worden. Der Gemeinsame Bundesausschuss (G-BA) zieht hingegen nach vier Jahren früher Nutzenbewertung eine durchwachsene Zwischenbilanz. 45% der neuen Arzneimittel gegen schwere Krankheiten nutzen nicht mehr als bisherige Medikamente.
Bald erste zugelassene Stammzelltherapie? Zum ersten Mal wurde von der EMA die Zulassung für ein Arzneimittel für neuartige Therapien empfohlen, das Stammzellen enthält. Holoclar® ist eine Therapie zur Behandlung eines limbalen Stammzelldefizits am Auge. Sie besteht aus lebendem limbalen Gewebe, das durch eine Biopsie aus der Cornea des Patienten gewonnen wird. Das Gewebe wächst anschließend im Labor in einem Zellkultursystem und wird dann in das betroffene Auge transplantiert, nachdem das nicht mehr intakte Cornea-Epithel entfernt wurde.
Kein Zusatznutzen für Aflibercept. Das IQWiG hat Aflibercept (Eylea®) von Bayer in einer erneuten frühen Nutzenbewertung unter die Lupe genommen. Es kommt zu dem Schluss, dass ein Zusatznutzen des Mittels bei diabetischem Makulaödem gegenüber der zweckmäßigen Vergleichstherapie nicht belegt ist. Das IQWiG hatte Aflibercept bereits zweimal für andere Indikationen am Auge bewertet. Beide Male sah das Institut einen Zusatznutzen als nicht belegt.
Revolution in der Arzneimittelzulassung? „Adaptive pathways“ heißt das Schlagwort der Arzneimittelzulassung der Zukunft. Vorgesehen ist eine frühe Zulassung für eine eingeschränkte Patientengruppe, basierend auf ersten kleinen klinischen Studien. Je nach dem Stand der Erkenntnisse aus der Anwendung könnte die Genehmigung dann sukzessive auf weitere Patientenpopulationen ausgedehnt werden. Eine Arzneimittelzulassung und sämtliche damit im Zusammenhang stehenden Vorgänge, inklusive der Versorgung und Erstattung, wären dann ständig im Fluss.
Erstes Humira-Biosimilar. Der viertgrößte indische Arzneimittelhersteller hat in Indien das erste Biosimilar zu Adalimumab (Humira®) unter dem Namen Exemptia® eingeführt. Der weltweite Jahresumsatz von Humira® wird auf rund 11 Milliarden US-Dollar (8,8 Mrd. Euro) beziffert. Der Preis von Exemptia® soll in Indien nur rund ein Fünftel betragen. In Deutschland kostet eine Injektionsdosis rund 900 Euro.
Mehr gegen Grippe geimpft. Das Robert Koch-Institut hat knapp 20.000 Personen zur Grippeschutzimpfung befragt. In der Wintersaison 2010/2011 haben sich danach 32% gegen Influenza impfen lassen. Damit ist die Grippe-Impfquote im Vergleich zur Wintersaison 2008/2009 mit etwa zwei Prozentpunkten leicht gestiegen.
Mehr MS in Deutschland. Immer mehr Menschen in Deutschland werden mit der Diagnose multiple Sklerose (MS) konfrontiert. Das zeigt eine Studie des IGES Instituts. Die Ergebnisse bestätigen andere epidemiologische Studien, konkretisieren aber die Zahlen für Deutschland. Hinter diesem Anstieg steckt vermutlich eine verbesserte Diagnostik. Auch der Anteil der Patienten, die spezifisch therapiert werden, hat sich erhöht.
Neues zu Therapie-Studien zu Ebola. Um die Ebola-Epidemie in Westafrika ist es in der letzten Woche ruhiger geworden. Dennoch wird weiter nach einem Impfstoff oder einem Behandlungskonzept gesucht. In der liberianischen Hauptstadt Monrovia wurde jetzt eine Studie zur Sicherheit und Wirksamkeit von Ebola-Rekonvaleszenten-Plasma gestartet. Die Plasma-Spender sind Personen mit einer überstandenen Ebola-Infektion. Ihr Antikörper-haltiges Plasma wird auf andere Erkrankte übertragen.





















20.12.2014, 07:00 Uhr