
- DAZ.online
- News
- Schärfere Regeln für ...
EP-Gesundheitsausschuss
Schärfere Regeln für Medizinprodukte
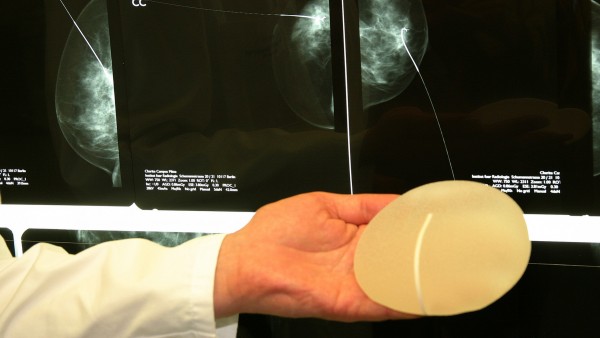
Mit großer Mehrheit hat der Gesundheitsausschuss im Europaparlament strengere EU-Regeln für Medizinprodukte beschlossen. Die Abgeordneten ziehen damit Konsequenzen aus dem Skandal um den französischen Implantat-Hersteller Poly Implant Prothèse, der mit billigem Industriesilikon gefüllte Brustimplantate herstellte, die viele Frauen sich wieder entfernen lassen mussten.
Bereits am Dienstag nahm die Europäische Kommission auf Basis der derzeit gültigen Richtlinie eine Durchführungsverordnung an – doch der Gesundheitsausschuss will mehr. Die von der Kommission beschlossenen Maßnahmen brächten zwar „einige konkrete Verbesserungen“, erklärte am Mittwochabend der gesundheitspolitische Sprecher der EVP-Christdemokraten im Europäischen Parlament, Dr. Peter Liese. Auf der gegenwärtigen Rechtsbasis könne man aber nicht so weit gehen, wie es für die Gewährleistung dauerhafter Sicherheit notwendig sei. „Auf Dauer brauchen wir aber Rechtssicherheit, deshalb ist die Verordnung, die heute im Ausschuss verabschiedet wurde, trotzdem notwendig.“
Der Vorschlag des Ausschusses sieht unter anderem unangekündigte Kontrollen in den Betrieben nach der Markteinführung vor. Des Weiteren sollen Einweg-Medizinprodukte künftig nicht mehr erneut aufbereitet werden dürfen, und in Fällen, in denen ein neues Produkt eine neue Technologie benutzt oder in denen es in der Vergangenheit Zwischenfälle gab, sollen erneute Prüfungen möglich sein. Zudem regelt die Verordnung, dass Medizinprodukte, die in den Körper implantiert werden, rückverfolgbar sein müssen und Patienten einen Implantatpass erhalten. Auch die Anforderungen an die über 80 Kontrollstellen in Europa und deren Personal sollen angehoben werden.
Nicht durchsetzen konnte sich im Ausschuss die Forderung der Sozialdemokraten nach einer zentralen Zulassung für Hochrisiko-Produkte. Auch der Bundesverband Medizintechnologie hatte vor der Abstimmung an die Abgeordneten appelliert, „nicht für ein neues bürokratisches Monster“ zu stimmen. Die Konservativen und Liberalen hätten die Forderung „auf Druck der Hersteller-Lobby“ verhindert, beklagt die SPD-Europaabgeordnete Dagmar Roth-Behrendt. Liese hält dagegen: „Wir müssen an die wirklichen Wurzeln des Problems gehen.“ Eine solche Zulassung hätte das Problem aus seiner Sicht nicht gelöst: „Bei Medikamenten gibt es dieses System, und trotzdem gibt es immer wieder Skandale.“ Außerdem hätte sie gerade für den Mittelstand zu viele bürokratische Hindernisse bedeutet.
Bevor am 22. Oktober das Europaparlament über die Verordnung abstimmt, muss zunächst der Rat zu einer eigenen Meinung finden. Anschließend starten die Verhandlungen mit den Mitgliedstaaten. Eine Einigung soll möglichst noch vor den Europawahlen 2014 erzielt werden.






















Berlin - 26.09.2013, 13:42 Uhr