
- DAZ.online
- News
- BPI: IQWiG darf Frü...
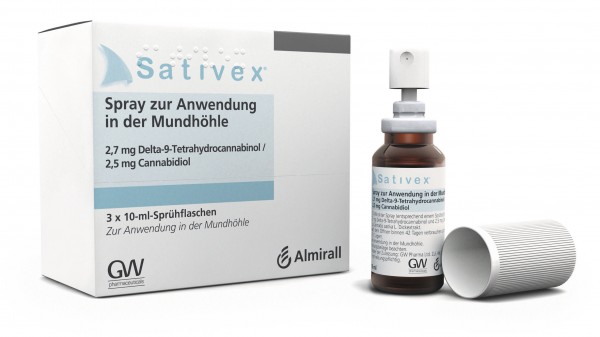
Cannabis-Arzneimittel Sativex®
BPI: IQWiG darf Frühbewertung nicht „torpedieren“
Der Bundesverband der Pharmazeutischen Industrie (BPI) kritisiert die Entscheidung des Instituts für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) zum Cannabis-Arzneimittel Sativex® zur Behandlung der Multiplen Skelerose. Sie beruhe „offenbar auf einer Fehlinterpretation der vom Gemeinsamen Bundesausschuss vorgegebenen Vergleichstherapie seitens des IQWiG“.
Nach Meinung des BPI missinterpretiert das IQWiG die eingereichten Studien und ignoriert die Evidenz des Zusatznutzens. Laut den Vorgaben des G-BA zur Vergleichstherapie sollten einer Therapie mit Cannabis-Extrakt mindestens zwei Therapieversuche mit verschiedenen anderen oralen Spasmolytika vorausgegangen sein. Von diesen eingesetzten Arzneimitteln sollte mindestens ein Arzneimittel Baclofen oder Tizanidin gewesen sein. Die Studien des Herstellers basierten nach Angaben des BPI auf einer eben solchen optimierten Therapie, zu der das Cannabis-Arzneimittel zusätzlich eingesetzt wurde. Das IQWiG hielt jedoch das Studiendesign für ungeeignet und verlangte – über die Forderungen des G-BA hinaus – eine fortlaufende Optimierung mit den bereits optimierten Arzneimitteln. Dem BPI zufolge muss der G-BA die Wahl seiner Vergleichstherapien „dringend“ schriftlich begründen, damit das IQWiG „nicht durch eigenwillige Auslegungen“ die Frühbewertung „torpediere“.
Es zeige sich erneut, dass das IQWiG nicht gewillt sei, dem G-BA eine brauchbare Bewertungsgrundlage zur Verfügung zu stellen, so Henning Fahrenkamp, Hauptgeschäftsführer des BPI. „Die Daten des Herstellers machen den Zusatznutzen unter Beachtung der Festlegungen des G-BA sehr deutlich, wenn man diese Festlegungen richtig verstehen und die vorgelegten Daten dann auch bewerten würde. Das IQWiG muss sich fragen lassen, ob es therapeutische Verbesserungen vorsätzlich negieren will“, so Fahrenkamp. „Im ‚lernenden System‘ lernen alle hinzu – bis auf das IQWiG“.
























Berlin - 10.04.2012, 14:45 Uhr