
- DAZ.online
- News
- Gentherapie zur NO-...
Koronare Herzkrankheit
Gentherapie zur NO-Produktion
Bochumer Kardiologen haben zusammen mit Medizinern aus den Herzzentren Hannover, Bad Nauheim, Mainz und Frankfurt eine erste Gentherapiestudie zur Vorbeugung erneuter Gefäßverschlüsse bei Patienten mit koronarer Herzkrankheit abgeschlossen.
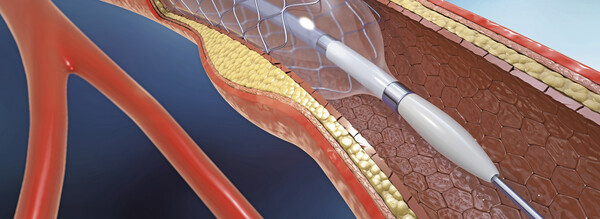
Bei der Koronargefäß-Angioplastie (perkutane transluminale koronare Angioplastie, PTCA) werden Stenosen in den Herzkranzgefäßen durch einen Katheter aufgedehnt. Bei vielen so behandelten Patienten verengen sich jedoch die Gefäße an derselben Stelle wieder. Früher waren bis zu 60 Prozent der Patienten von solchen Restenosen betroffen. Durch den Einsatz von Stents sank die Häufigkeit auf unter 30 Prozent; dank medikamentenbeschichteter Stents liegt sie heute bei rund 10 Prozent. Die dafür genutzten Arzneimittel wirken antiproliferativ, das heißt, sie mindern das Zell- und Gewebewachstum nach der unvermeidlichen Verletzung des Gefäßes bei der Aufdehnung. Allerdings behindern sie auch sinnvolle Reparaturmechanismen. So hindern sie zum Beispiel gefäßauskleidende Endothelzellen daran, die Gefäßwand und den Stent zu besiedeln. Ohne „Endothelzellschutz“ bedeuten die Stents eine Gefahr. Um den akuten Stentverschluss zu verhindern, müssen die Patienten bis zu einem Jahr lang gerinnungshemmende Arzneimittel einnehmen, die wiederum Blutungsrisiken bedeuten.
Endothelzellen kleiden die Blutgefäße von innen aus und schützen vor einem thrombotischen Verschluss, weil sie unter anderem Stickstoffmonoxid (NO) freisetzen. Das dazu notwendige Enzym ist die NO-Synthase. NO hemmt die Anheftung und Verklumpung von zirkulierenden Blutplättchen, verhindert die Anheftung von Entzündungszellen an der Gefäßwand, wirkt antiproliferativ auf bestimmte Bindegewebszellen und glatte Muskelzellen, stimuliert aber die erwünschte Besiedlung des Stents mit Endothelzellen. Wahrscheinlich wirkt NO Gefäßverschlüssen entgegen und verhindert somit auch die Entwicklung von Restenosen.
NO ist sehr kurzlebig und kann als Arzneistoff nicht in ausreichender Konzentration verabreicht werden. In der aktuellen Studie wurde nun bei 30 Patienten der Bauplan für die NO-Synthase während der PTCA in Zellen der Gefäßwand eingeschleust, so dass sie über längere Zeit vor Ort NO freisetzen. Für die Studie wählten die Forscher die induzierbare NO-Synthase (iNOS), die, einmal „angeschaltet“, große Mengen NO produzieren kann. Das menschliche Gen für iNOS wurde mit einem Lipid-Komplex ummantelt, und mit einem Spezialkatheter während der PTCA mit Druck in die Gefäßwand injiziert. Dadurch nahmen die Zellen der Gefäßwand das iNOS-Gen auf, und dieses drang auch in benachbarte Zellen ein. Das iNOS-Gen führt dann zur Herstellung der Synthase in den Zellen und letztlich zu einer massenhaften lokalen Produktion von NO. NO wird dann über mehrere Tage, möglicherweise über Wochen produziert. In diesem frühen Zeitraum wird offensichtlich zellulär die „Weiche“ gestellt, ob sich später wieder eine Engstelle im Gefäß bildet oder nicht.
Die Methode ist beim Patienten grundsätzlich anwendbar. Sowohl die Fallzahl als auch der bisherige Beobachtungszeitraum von sechs Monaten reichen derzeit nicht aus, um einen klinischen Nutzen hinsichtlich der Rate von Restenosen zu belegen. Gedacht ist das Wirkprinzip zur Implementierung in medikamentenbeschichtete Ballons oder Stents, um das Instrumentarium zur Vermeidung von Restenosen ohne erhöhtes Risiko für thrombotische oder Blutungskomplikationen weiter zu entwickeln.
Quelle: v. d. Leyen, H., et al.: Human Gene Therapy 2011;22, Online-Vorabpublikation, DOI:10.1089/hum.2010.161




















Bochum - 12.02.2011, 07:32 Uhr