
- DAZ.online
- DAZ / AZ
- DAZ 33/2009
- Thalidomid unterdrückt ...
Arzneimittel und Therapie
Thalidomid unterdrückt Immunsystem
Thalidomid kam 1957 als Schlafmittel Contergan® auf den Markt und führte in der Folge in den 60-iger Jahren zu Missbildungen bei Neugeborenen, dem so genannten Contergan-Skandal. Am 27. November 1961 wurde das Mittel vom Markt genommen. In diesen vier Jahren wurden in Deutschland 5000 Kinder mit Missbildungen der Arme und Beine geboren, weltweit waren es mehr als 12.000.
Jetzt kommt der teratogene Wirkstoff mit einer neuen Indikation auf den Markt: Thalidomid ist in Kombination mit Melphalan und Prednison für die Erstlinienbehandlung von Patienten mit unbehandeltem Multiplen Myelom ab einem Alter von über 65 Jahren oder von Patienten, für die eine hochdosierte Chemotherapie nicht in Frage kommt, zugelassen.
Zahlreiche Wirkungen
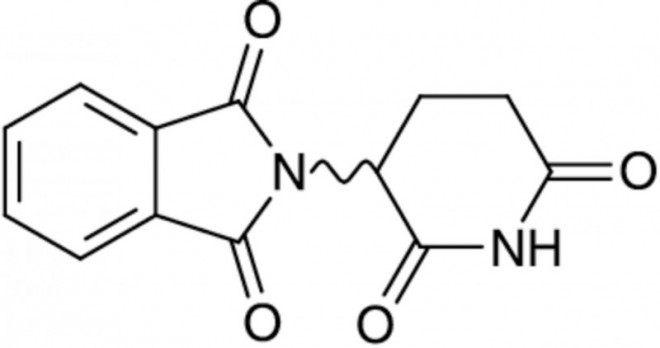
Thalidomid gehört zur Gruppe der Piperidindione, die strukturelle Abwandlungen der Barbiturate sind. Die chirale Verbindung liegt in Form des razemischen Gemischs der beiden Enantiomere vor, die im Körper ineinander umgewandelt werden. Im Jahr 2007 wurde mit Lenalidomid (Revlimid®) bereits ein Strukturanalogon von Thalidomid zur Behandlung des multiplen Myeloms zugelassen.
Thalidomid und Lenalidomid wirken immunmodulatorisch, antiinflammatorisch und antiproliferativ. Diese Wirkungen stehen möglicherweise mit einer Unterdrückung der übermäßigen Tumornekrosefaktor-alpha-Produktion, Hemmung bestimmter, an der Leukozytenmigration beteiligter Adhäsionsmoleküle der Zelloberfläche und der antiangiogenetischen Aktivität in Zusammenhang. Diskutiert wird eine Blockade des endothelialen Wachstumsfaktors VEGF (Vascular Endothelial Growth Factor) .
Hemmung der Angiogenese
Die Hemmung der Angiogenese führt bei der Embryonalentwicklung dazu, dass die Bildung neuer Blutgefäße unterbleibt. Geschieht dies in der frühen Phase der Schwangerschaft, werden lebenswichtige Organe geschädigt, und das Ungeborene stirbt. In einer späteren Phase sind dann ausschließlich die Extremitäten betroffen, und die Kinder werden mit den typischen Missbildungen geboren.
Dabei wirkt nicht Thalidomid selbst teratogen, sondern Metabolite, die bei der Umwandlung in der Leber entstehen. Da die Metabolisierung bei den in den 50-iger Jahren verwendeten Labortieren anders ablief, konnten die Fehlbildungen weder bei ihnen noch bei Hühnerembryonen oder in Zellkulturen beobachtet werden.
Einsatz bei Autoimmunerkrankungen und Lepra
Die Wirkungen von Thalidomid können bei verschiedenen Krankheiten ausgenutzt werden, zum Beispiel wird Thalidomid bei Autoimmunerkrankungen wie Lupus erythematodes und auch zur Behandlung von Aids erprobt. Im Jahr 1964 fand der israelische Hautarzt Jacob Sheskin, dass sich Lepra-Geschwüre unter einer Behandlung mit Thalidomid zurückbilden. Als Folge wurde Thalidomid vor allem in südamerikanischen Ländern wie Kolumbien und Brasilien gegen Lepra eingesetzt. Da die Rate der Analphabeten in Brasilien hoch ist, missverstanden viele Frauen das Etikett mit einer durchgestrichenen schwangeren Frau auf der Verpackung als Antibabypille. Dadurch kam es in Brasilien zu einer neuen Generation schwer fehlgebildeter Kinder. Heute hat sich Thalidomid in Brasilien als verschreibungspflichtige Standardmedikation gegen Lepra durchgesetzt und gilt als das wirksamste Mittel gegen die Seuche.
Bösartiger Tumor der B-Lymphozyten
Bei uns wird Thalidomid jetzt zur Behandlung des Multiplen Myeloms eingeführt.
Das Multiple Myelom ist ein bösartiger Tumor der B-Lymphozyten, das zu den Non-Hodgkin-Lymphomen gehört. Dabei entartet eine Plasmazelle des Knochenmarks, die sich dann klonal unkontrolliert vor allem im Knochenmark vermehrt. Charakteristischerweise kommt es bei der Erkrankung zu einer Häufung dieser Plasmazelltumore ("multiple Myelome") an verschiedenen Stellen des Skelettsystems.
Wahrscheinlich wirkt Thalidomid hier über die Hemmung des Tumornekrosefaktors alpha (TNF α) und über eine Stimulierung zytotoxischer T-Zellen. Durch die Hemmung der Angiogenese wird die Gefäßneubildung im Bereich des Knochenmarks und damit die Blutversorgung der Krebszellen unterdrückt. Thalidomid führt bei vielen Patienten zu einer Verbesserung der peripheren Blutzellwerte, bis hin zur Normalisierung.
Das Multiple MyelomDas Multiple Myelom ist ein bösartiger Tumor der B-Lymphozyten, das zu den Non-Hodgkin-Lymphomen gehört. Dabei entartet eine Plasmazelle des Knochenmarks, die sich dann klonal unkontrolliert vor allem im Knochenmark an verschiedenen Stellen des Skelettsystems vermehrt. Die Myelomzellen produzieren monoklonale Immunglobuline (meist IgG oder IgA) ohne physiologische Antikörperfunktion oder Antikörperbruchstücke. Da zu wenig funktionelle Antikörper produziert werden, sind Myelom-Patienten sehr anfällig für Infektionen. Außerdem erhöhen die in großen Mengen produzierten Antikörper die Blutviskosität und erschweren damit die Blutzirkulation, was zu einer Vielzahl von Symptomen, wie Benommenheit, Schwindel, Seh- und Hörstörungen, führt. Die Wucherungen der Myelomzellen bewirken eine Auflösung von Knochensubstanz (Osteolyse) mit Knochendefekten als Folge. Durch den Knochenabbau werden Calciumionen in großen Mengen in die Blutbahn freigesetzt, was zur Nierenschädigung führen kann. Betroffen sind vor allem Menschen jenseits des 65. Lebensjahres, in Deutschland derzeit etwa 12.000. Jährlich erkranken rund 3500 Menschen neu. Das mediane Lebensalter bei der Erstdiagnose beträgt 66 Jahre, der Erkrankungsgipfel liegt zwischen 75 und 85 Jahren. Die Prognose des Multiplen Myeloms ist schlecht: Bei Diagnosestellung beträgt die durchschnittliche Überlebenszeit drei Jahre. Therapeutisch können bisher vor allem das Überleben etwas verlängert und dazu die häufig sehr schmerzhaften Komplikationen gelindert werden. Die Progression lässt sich durch eine Hochdosischemotherapie mit autologer Stammzellreinfusion zumindest zeitweise verzögern. Allerdings sprechen etwa 10 bis 30 % der Patienten nicht auf die erste Chemotherapie an, und fast alle Patienten erleiden Rezidive. 2004 kam zur Behandlung des Multiplen Myeloms der Proteasomen-Inhibitor Bortezomib (Velcade®) auf den Markt. 2007 wurde Lenalidomid (Revlimid®) eingeführt, und jetzt folgt das Strukturanalogon Thalidomid. |
18 Monate länger leben
Die empfohlene orale Dosis zur Behandlung des Multiplen Myeloms beträgt 200 mg pro Tag und kann unabhängig von der Nahrung eingenommen werden. Es sollten maximal zwölf Zyklen von jeweils sechs Wochen gegeben werden. Um die Auswirkungen von Somnolenz zu reduzieren, sollte Thalidomid als Einzeldosis vor dem Schlafengehen eingenommen werden.
Nach der oralen Gabe wird Thalidomid langsam absorbiert, maximale Plasmakonzentrationen werden zwei bis fünf Stunden nach Einnahme erreicht. Thalidomid wird hauptsächlich durch nicht enzymatische Hydrolyse eliminiert, die mittlere Eliminations-Halbwertszeit von Thalidomid im Plasma beträgt nach oralen Einzeldosen von 50 bis 400 mg zwischen 5,5 und 7,3 Stunden. Thalidomid ist ein schlechtes Substrat für die Cytochrom-P450-Isoenzyme; daher sind klinisch relevante Wechselwirkungen mit Arzneimitteln, die durch diese Enzyme metabolisiert werden, unwahrscheinlich.
Die Ergebnisse einer randomisierten, multizentrischen, offenen Phase-III-Studie im Parallelgruppenvergleich zeigen einen Überlebensvorteil, wenn Thalidomid in Kombination mit Melphalan und Prednison (MPT) über zwölf Zyklen von je sechs Wochen zur Behandlung von Patienten mit neu diagnostiziertem Multiplem Myelom angewendet wird. In dieser Studie waren die Patienten zwischen 65 und 75 Jahre alt. Die Dosis von Melphalan lag bei 0,25 mg/kg pro Tag und die Dosis von Prednison bei 2 mg/kg pro Tag an den Tagen 1 bis 4 eines jeden sechswöchigen Zyklus. Das mediane Gesamtüberleben betrug 51,6 ± 4,5 Monate in der MPT-Behandlungsgruppe bzw. 33,2 ± 3,2 Monate in der MP-Behandlungsgruppe (97,5% Konfidenzintervall: 0,42 bis 0,84). Diese Differenz von 18 Monaten war statistisch signifikant. Für den MPT-Arm ergab sich eine Verringerung des Sterberisikos mit einer Hazard Ratio von 0,59 (97,5% Konfidenzintervall: 0,42 bis 0,84 und p-Wert von 0,001).
Periphere Neuropathie
Zu den häufigsten Nebenwirkungen der Therapie gehören Neutropenie, Leukopenie, Obstipation, Somnolenz, Parästhesie, periphere Neuropathie, Anämie, Lymphopenie, Thrombozytopenie, Schwindel, Dysästhesie, Tremor und periphere Ödeme. Schwerwiegende Nebenwirkungen sind tiefe Venenthrombose und pulmonale Embolie, schwere Hautreaktionen, Synkopen und Bradykardie. Eine periphere Neuropathie kann zu irreversiblen Schäden führen. Zu den Symptomen gehören Parästhesie, Dysästhesie, leichte Schmerzen, Koordinationsstörungen oder Schwäche. In einer Phase-III-Studie lag die mediane Zeit bis zum ersten Auftreten einer peripheren Neuropathie bei 42,3 Wochen, die unerwünschte Wirkung kann jedoch auch nach relativ kurzzeitiger Anwendung auftreten. Die Inzidenz von Neuropathien steigt mit kumulativer Dosis und Therapiedauer.
Thalidomid hat sedative Eigenschaften, so dass es zu einer Verstärkung der Sedierung kommen kann, die durch Anxiolytika, Hypnotika, Antipsychotika, H1 -Antihistaminika, Opiatderivate, Barbiturate und Alkohol verursacht wird. Die Gabe von Thalidomid in Kombination mit Arzneimitteln, die Schläfrigkeit verursachen, sollte mit Vorsicht erfolgen.
Teratogene Wirkung beachten
Thalidomid darf niemals von Frauen eingenommen werden, die schwanger sind. Frauen, die schwanger werden könnten und ebenso alle männlichen Patienten müssen die Anforderungen des Thalidomide Celgene-Schwangerschafts-Präventionsprogramms erfüllen.
Die Patientin muss eine zuverlässige Kontrazeption ohne jegliche Unterbrechung vier Wochen vor Therapiebeginn, während der gesamten Dauer der Behandlung und vier Wochen nach Beendigung der Therapie durchführen. Bei gebärfähigen Frauen sollte das Rezept für eine Behandlungsdauer von maximal vier Wochen ausgestellt werden, die Abgabe sollte innerhalb von maximal sieben Tagen nach Ausstellung des Rezeptes erfolgen.
Da Thalidomid im Sperma vorhanden ist, müssen männliche Patienten ein Kondom verwenden, wenn sie mit einer schwangeren Frau oder einer Frau im gebärfähigen Alter, die keine zuverlässige Verhütungsmethode anwendet, sexuell verkehren. Die Patienten dürfen das Arzneimittel niemals an eine andere Person weitergeben und sollten alle nicht eingenommenen Kapseln nach Abschluss der Behandlung an ihre Apotheke zurückgeben. Während der Behandlung und eine Woche nach Abschluss dürfen die Patienten weder Blut noch Samen spenden.
Nicht über Versandhandel
In Deutschland unterliegt die Abgabe von Thalidomid und Lenalidomid der amtlichen Überwachung. Deshalb muss der Arzt für die Verordnung ein spezielles, zweiteiliges Rezeptformular verwenden, das vom Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) personengebunden ausgegeben wird und ausschließlich zur Verschreibung der genannten Arzneimittel vorgesehen ist. Für zusätzliche Sicherheit soll sorgen, dass die Rezepte nur sechs Tage gültig sind. Die Verschreibungs-Höchstmenge darf je Rezept für Frauen im gebärfähigen Alter den Bedarf für vier Wochen, ansonsten für zwölf Wochen nicht übersteigen. Die Apotheken müssen die Abgabe analog zu Betäubungsmitteln oder Blutzubereitungen sorgfältig dokumentieren. Die Durchschriften der eingelösten Rezepte müssen vierteljährlich an das BfArM geschickt werden. Im Wege des Versandhandels dürfen weder Thalidomid noch Lenalidomid in den Verkehr gebracht werden.
Quelle
Fachinformation zu Thalidomide Celgene, Stand Februar 2009.
Therapontos, C., et al.: Thalidomide induces limb defects by preventing angiogenetic outgrowth during early limb formation. Proc. Natl. Acad. Sci. 2009: 106(21); 8573-8578.
hel
Thalidomid
Handelsname: Thalidomide Celgene
Hersteller/Vertreiber: Celgene GmbH, München
Einführungsdatum:
15. Juli 2009
Zusammensetzung:
Jede Kapsel enthält 50 mg Thalidomid. Sonstige Bestandteile: Kapselinhalt: Lactose, mikrokristalline Cellulose, Crospovidon (Typ A), Povidon (K90), Stearinsäure, hochdisperses Siliciumdioxid. Kapselhülle: Gelatine, Titandioxid (E 171). Drucktinte: Schellack, Eisen(II,III)-oxid (E 172), Propylenglycol.
Packungsgrößen, Preise und PZN:
28 Tabletten, 490,11 Euro, PZN 1223216.
Stoffklasse:
Zytostatika; Immunsuppressivum. ATC-Code: LO4AX02.
Indikation:
In Kombination mit Melphalan und Prednison für die Erstlinienbehandlung von Patienten mit unbehandeltem multiplen Myelom ab einem Alter von 65 Jahren oder von Patienten, für die eine hochdosierte Chemotherapie nicht in Frage kommt.
Dosierung:
200 mg oral pro Tag, maximal zwölf Zyklen von jeweils sechs Wochen.
Gegenanzeigen:
Schwangerschaft; Frauen im gebärfähigen Alter, es sei denn, alle Anforderungen des Schwangerschafts-Präventionsprogramms werden erfüllt. Patienten, die die erforderlichen Verhütungsmaßnahmen nicht anwenden können oder wollen.
Nebenwirkungen:
Sehr häufig: Neutropenie, Leukopenie, Anämie, Lymphopenie, Thrombozytopenie; periphere Neuropathie, Tremor, Schwindel, Parästhesie, Dysästhesie, Somnolenz; Obstipation; periphere Ödeme. Häufig: Herzinsuffizienz, Bradykardie; Koordinationsstörungen; Lungenembolie, Interstitielle Lungenerkrankung, Bronchopneumopathie, Dyspnoe; Erbrechen, Mundtrockenheit; toxische Hauteruption, Hautausschlag, trockene Haut; Pneumonie; tiefe Venenthrombose; Fieber, Asthenie, Unwohlsein; Verwirrtheit, Depression.
Wechselwirkungen:
Thalidomid hat sedative Eigenschaften, die Gabe in Kombination mit Arzneimitteln, die Schläfrigkeit verursachen, sollte mit Vorsicht erfolgen. Thalidomid kann eine Bradykardie und sollte zusammen mit Arzneimitteln, die die gleiche pharmakodynamische Wirkung besitzen, mit Vorsicht angewendet werden. Arzneimittel, die mit dem Auftreten einer peripheren Neuropathie in Verbindung gebracht werden (z. B. Vincristin und Bortezomib), sollten bei Patienten, die Thalidomid erhalten, mit Vorsicht angewendet werden. Die Anwendung von kombinierten hormonellen Kontrazeptiva aufgrund des erhöhten Risikos für venöse thromboembolische Ereignisse wird nicht empfohlen.
Warnhinweise und Vorsichtsmaßnahmen:
Thalidomid wirkt beim Menschen hochgradig teratogen und führt zu schwerwiegenden und lebensbedrohlichen Missbildungen, es darf daher niemals von Frauen eingenommen werden, die schwanger sind; Frauen, die schwanger werden könnten und ebenso alle männlichen Patienten müssen die Anforderungen des Thalidomide Celgene-Schwangerschafts-Präventionsprogramms erfüllen; da Thalidomid im Sperma vorhanden ist, müssen männliche Patienten ein Kondom verwenden, wenn sie mit einer schwangeren Frau oder einer Frau im gebärfähigen Alter, die keine zuverlässige Verhütungsmethode anwendet, sexuell verkehren. Unter der Behandlung mit Thalidomid besteht ein erhöhtes Risiko für tiefe Venenthrombose und pulmonale Embolie; mindestens während der ersten fünf Monate der Behandlung sollte insbesondere bei Patienten mit weiteren thrombogenen Risikofaktoren eine Thromboseprophylaxe durchgeführt werden. Eine periphere Neuropathie ist eine sehr häufige und potenziell schwerwiegende Nebenwirkung der Behandlung mit Thalidomid, die zu irreversiblen Schäden führen kann; die Inzidenz von Neuropathien steigt mit kumulativer Dosis und Therapiedauer. Patienten sollten hinsichtlich des Auftretens von Synkopen und Bradykardien sowie toxischen Hautreaktionen beobachtet werden. Patienten mit schweren Nieren- oder Leberfunktionsstörungen sollten auf Nebenwirkungen beobachtet werden. Thalidomid verursacht häufig Somnolenz.
|

























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.