
- DAZ.online
- News
- Wirtschaft
- FDA will schnelle ...
MERCK-UND-PFIZER-ENTWICKLUNG
FDA will schnelle Zulassung von Krebsarzneimittel Avelumab
Berlin - 18.11.2015, 17:27 Uhr
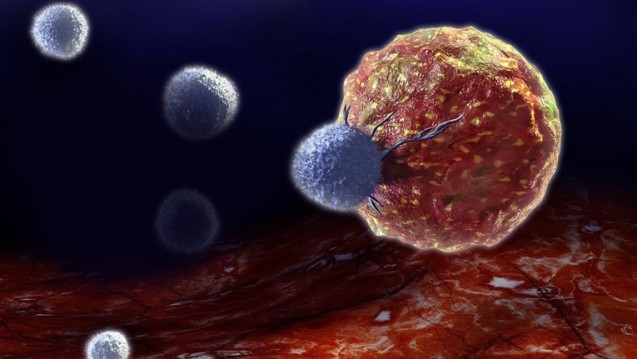
Kutanes neuroendokrines Karzinom: Bei der seltenen und aggressiven Erkrankung bilden sich Krebszellen auf der obersten Hautschicht in unmittelbarer Nähe zu den Nervenenden. (Illustration: Merck)
Die amerikanische Zulassungsbehörde FDA hat für Avelumab den Breakthrough Therapy-Status ausgegeben. Das Arzneimittel wird derzeit gemeinsam von Pfizer und der Merck KGaA entwicklet - für die Behandlung des metastasierten Merkelzellkarzinoms.
Die US-Gesundheitsbehörde FDA prüft das gemeinsam von den Pharmakonzernen Merck KGaA und Pfizer in der Entwicklung befindliche Krebsarzneimittel Avelumab für eine bestimmte Indikation besonders schnell. Die Krebsimmuntherapie habe den sogenannten Breakthrough Therapy-Status für die Behandlung des metastasierten Merkelzellkarzinoms (MMC) erhalten, teilten beide Unternehmen am Mittwoch mit. Der Breakthrough-Status soll die Entwicklung und Beurteilung von Arzneimitteln beschleunigen, die zur Behandlung schwerwiegender Erkrankungen eingesetzt werden sollen.
Avelumab ist ein rein humaner, monoklonaler IgG1-Antikörper, der auf den programmierten Zelltod-Liganden 1 (PD-L1) abzielt. Bei MCC handelt es sich um einen seltenen und aggressiven Hauttumor. In den USA werden jährlich rund 1.500 neue Fälle von MCC diagnostiziert. Derzeit gibt es keine Therapie, die speziell für die Behandlung von metastasiertem MCC zugelassen ist.
Bereits Fast-Track-Status
Zuletzt hatte das Arzneimittel bereits mit dem Fast-Track- und dem Orphan Drug-Status in den USA bei einer möglichen Zulassung für diese Indikation die Überholspur eingeschlagen. Den Status Orphan Drug erteilte die FDA im September für das Mitteln gegen die seltene Erkrankung. Mit dem Fast-Track-Verfahren hatte sich die FDA im Oktober bereits verpflichtet innerhalb von 60 Tagen über eine Zulassung zu entscheiden.
Der Darmstädter Dax-Konzern Merck und sein amerikanischer Konkurrent Pfizer hatten die Kooperation im November 2014 vereinbart, um ihre Präsenz in der Krebsimmuntherapie zu stärken. Beide Seiten teilen sich die Kosten für die Entwicklung und die Markteinführung sowie die späteren Umsätze.























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.