
- DAZ.online
- News
- Bundesregierung sieht ...
Teure MS-Mittel
Bundesregierung sieht keinen Handlungsbedarf
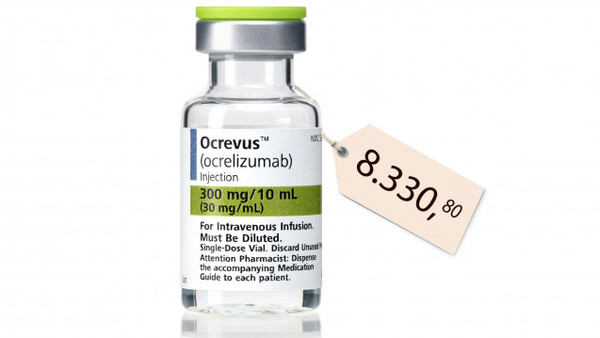
Wie viele Menschen in Deutschland an Multipler Sklerose (MS) erkrankt sind, ist unklar. Sagen lässt sich aber: Immunmodulatoren bei MS sind einer der größten Kostenfaktoren im Arzneimittelbereich. Da MS-Patienten lange leben, seien Umsätze von rund 1 Million Euro pro Patient realistisch, meint die Linksfraktion. Sie beobachtet daher kritisch, wie weitere Pharmafirmen in den MS-Markt dringen. In einer Kleinen Anfrage hat die Linke nun bei der Bundesregierung nachgehakt, wie es um die Versorgungslage, die Evidenz und die Kosten der MS-Therapie bestellt ist.
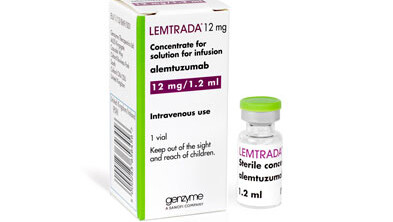
Ein besonderer Dorn im Auge ist der Linken das Genzyme-Präparat Lemtrada® (Alemtuzumab). Der Wirkstoff wurde 2012 als Leukämie-Mittel MabCampath® vom Markt genommen – dann wurde es mit einem weitaus höheren Preis als MS-Mittel wieder eingeführt. Die frühe Nutzenbewertung entfällt bei der Zulassung neuer Arzneimittel mit älteren Wirkstoffen. Ähnliches befürchtet die Linksfraktion bezüglich des Wirkstoffes Dimethylfumarat (DMF) als Monopräparat: Dieser sollte zunächst als Panaclar® gegen Schuppenflechte zugelassen werden. Nachdem sich zeigte, dass der Wirkstoff auch bei MS wirksam ist, sei er unter dem Handelsnamen Tecfidera® auf dem Markt eingeführt worden, schreibt die Fraktion in ihrer Anfrage. Der Preis sei erheblich höher als es für ein Psoriasis-Mittel möglich gewesen wäre. Nun zieht die Linke Parallelen und fragt, ob die Regierung hier Handlungsbedarf sieht, um derartige Fälle künftig zu unterbinden.
Die Bundesregierung stellt klar, dass sich die vorhandenen Regelungen zur Zulassung und Erstattung von Arzneimitteln in Deutschland grundsätzlich bewährt habe. „Sie gewährleisten eine zuverlässige und wirtschaftliche medizinische Versorgung der Bevölkerung mit sicheren und wirksamen Arzneimitteln“ heißt es in der Antwort. Für die Patienten sei maßgeblich, dass das Nutzen-Risiko-Verhältnis des Arzneimittels positiv ist. Das sei durch die arzneimittelrechtliche Zulassung gewährleistet. „Dabei ist es weniger entscheidend, ob das Arzneimittel einen neuen oder einen bereits bekannten Wirkstoff enthält.“
Ob die Ausgaben für die Arzneimittelversorgung überproportional steigen und dadurch die finanzielle Stabilität der gesetzlichen Krankenversicherung gefährden könnten, werde „sorgfältig beobachtet, um darauf gegebenenfalls geeignete gesetzgeberische Maßnahmen vorzuschlagen, wenn dies notwendig werden sollte“. Um einen Zusatznutzen gegenüber den bisher verfügbaren Therapiemöglichkeiten zu belegen, muss der Wirkstoff die frühe Nutzenbewertung durchlaufen. Das Zusammenspiel von Nutzenbewertung und anschließenden Preisverhandlungen sieht die Regierung dabei als „lernendes System, das bei Bedarf weiterentwickelt werden kann“.
Dass der Fall Lemtrada® Schule macht, kann die Bundesregierung indes nicht bestätigen: Lemtrada® habe die frühe Nutzenbewertung nicht durchlaufen, da das Arzneimittel vor dem 1. Januar 2011 in Verkehr gebracht wurde. Für DMF als MS-Mittel Tecfidera® gelte dies allerdings nicht: Der Zulassungsantrag für DMF als Panclar® für die Anwendungsgebiete „Mittelschwere bis schwere Psoriasis“ wurde beim Bundesinstitut für Arzneimittel und Medizinprodukte zwar im Jahr 2005 eingereicht – jedoch wieder zurückgezogen, weshalb das Zulassungsverfahren im Mai 2006 eingestellt wurde. Da der Wirkstoff als Psoriasis-Medikament nicht zugelassen und daher nicht auf dem Markt war, durchlaufe dieser als MS-Mittel derzeit ordnungsgemäß die frühe Nutzenbewertung nach § 35a SGB V – mit anschließender Preisverhandlung.























Berlin - 17.06.2014, 16:07 Uhr