
- DAZ.online
- DAZ / AZ
- DAZ 8/2012
- Vitamin B12 fürs Gehirn
Vitamin B12
Vitamin B12 fürs Gehirn
Die Folgen eines Vitamin-B12 -Mangels werden unterschätzt
Biochemische Grundlagen
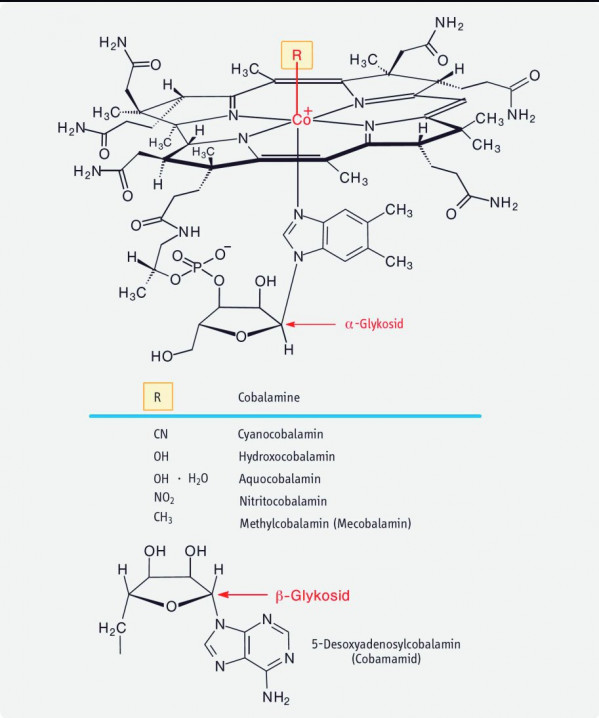
Das Grundgerüst von Vitamin B12 ist das Corrin, bestehend aus vier reduzierten Pyrrolringen, mit einem zentralen Kobaltatom (Abb. 1). Substitutionen am sechsten Liganden des Kobaltatoms führen zu folgenden Verbindungen:
CN → Cyanocobalamin,
OH → Hydroxocobalamin,
H2O → Aquocobalamin,
NO → Nitritocobalamin
CH3 → Methylcobalamin
5-Desoxyadenosyl → Adenosylcobalamin.
Vitamin B12 ist ein Sammelbegriff für diese Corrinoide. Biochemisch vorrangig sind zwei Vertreter, die in getrennten Zellkompartimenten gebildet und wirksam werden: Methylcobalamin im Cytosol und Adenosylcobalamin in den Mitochondrien.
Methylcobalamin dient als Cofaktor der Methioninsynthase, die die Remethylierung von Homocystein zu Methionin katalysiert, wobei die Methylgruppe von der 5-Methyl-tetrahydrofolsäure stammt. Als wichtiges Coenzym im Methylgruppentransfer ist es für die Übertragung von C1‑Körpern bedeutungsvoll, u. a. für die Cholin- und Thymidinbiosynthese sowie für die Methylierung von Uridin zu Thymidin.
Adenosylcobalamin wird in den Mitochondrien gebildet, indem das Zentralatom Co3+ durch NADH/H+ und FADH2 zu Co+ reduziert und der Adenosylrest von ATP geliefert wird. Es ist an zwei intramolekularen Prozessen beteiligt:
Umlagerung von Methylmalonyl-CoA zu Succinyl-CoA durch die Methylmalonyl-CoA-Mutase; wichtig für den Abbau ungerader Kohlenstoffketten von Aminosäuren (Threonin, Valin, Methionin) und Fettsäuren (Propionyl-CoA); bei Cobal-aminmangel wird die Methylmalonyl-CoA zu Methylmalonsäure hydrolysiert und mit dem Urin ausgeschieden.
Reversible Umwandlung von Leucin in β-Leucin.
Mangelsymptome
Der Mangel an Vitamin B12 äußert sich beim Menschen vorrangig durch
Störungen der Blutbildung, speziell der Bildung der Erythrozyten,
neurologisch-psychiatrische Störungen und
epitheliale Veränderungen der Mukosa des Verdauungstraktes [16].
Die hämatopoetischen und neurologischen Störungen können mit schwerwiegenden und zum Teil lebensbedrohlichen Erkrankungen verbunden sein. Während die Blutbildveränderungen sehr charakteristisch sind und daher schnell zur Diagnose des Vitamin-B12 -Mangels führen, sind die neurologischen Störungen weitaus vielfältiger und werden in der klinischen Praxis oft nicht als Folgen eines Vitamin-B12-Mangels erkannt; dennoch sind sie oft die frühesten und zum Teil auch einzigen klinischen Symptome eines funktionellen Vitamin-B12-Mangels. Die Angaben zur Häufigkeit variieren. Nach Angaben des Institute of Medicine in Washington haben 75 bis 90% der Personen mit klinisch relevantem Vitamin-B12-Mangel neurologische Störungen, und in etwa 25% der Fälle sind sie die einzigen klinischen Manifestationen des Vitamin-B12-Mangels [20].
Die neurologischen Störungen können gemeinsam mit den hämatologischen Veränderungen oder isoliert auftreten. Etwa 60% der Patienten mit perniziöser Anämie weisen auch Symptome einer funikulären Myelose (s. u.) auf. Etwa ein Viertel der Patienten mit Vitamin-B12-Mangel und neurologischen Störungen hat keine hämatologischen Veränderungen. Interessanterweise besteht eine inverse Korrelation zwischen den hämatologischen und den neurologischen Störungen [5]: Je stärker die neurologischen Störungen sind, umso geringer sind die hämatologischen Veränderungen und vice versa. Die Ursachen dafür sind unbekannt.
Neurologische Symptome
Typische neurologische Symptome sind: Parästhesien oder Taubheitsgefühl der Haut, "eingeschlafene" Hände oder Füße, Gangunsicherheit und Koordinationsstörungen bis hin zu Lähmungen. Sie sind Ausdruck der funikulären Myelose, einer subakuten kombinierten Degeneration der Seiten- und Hinterstränge des Rückenmarkes aufgrund eines Defektes der Myelinscheiden (Entmarkung) [13, 18]. Betroffen sind
die Hinterstrangbahnen, die die taktile Wahrnehmung und Propriozeption (Wahrnehmung von Körperbewegung und -lage) vermitteln,
die Kleinhirnseitenstrangbahnen, die ebenfalls der Propriozeption dienen, und
die Pyramidenbahn, die die Bewegungen steuert.
Die daraus entstehende Neuropathie ist symmetrisch und befällt die Beine stärker als die Arme. Am häufigsten ist die sensomotorische periphere Polyneuropathie, es kommen aber auch Mononeuropathien (optische oder olfaktorische) und autonome Neuropathien (Impotenz, Inkontinenz) vor [2, 18].
Die Parästhesie tritt zuerst an den Füßen oder Händen auf und breitet sich im Verlauf der Erkrankung auf Beine und Arme aus. Auf die sensorischen Störungen folgen motorische Störungen (Muskelschwäche, Lähmungserscheinungen, Störungen der Bewegungskoordination). Die Nervenleitgeschwindigkeit ist vermindert. Unbehandelt endet die Erkrankung schlimmstenfalls in einer Querschnittslähmung.
Außerdem kann es durch die Schädigung zentraler Nervenbahnen zu zerebralen Störungen und dadurch (und darüber hinaus) zu psychiatrischen Symptomen wie Verwirrung, Stupor, Apathie sowie Störungen des Gedächtnisses und der Urteilsfähigkeit kommen, aber auch zu Psychosen, Depressionen, Demenz oder sogar Katatonie [18]. Die zerebralen Störungen sind seltener als die peripheren Störungen, werden aber in der Praxis unterschätzt.
Besonders gravierend ist ein Vitamin-B12-Mangel bei alten Personen, weil er die Hirnatrophie beschleunigt, und bei Müttern, weil er bei deren Kindern schwerwiegende hämatologische und neurologische Störungen verursachen kann [3].
Diagnostik des Vitamin-B12-Mangels
Die Diagnose eines Vitamin-B12-Mangels erfolgt üblicherweise durch die Bestimmung des Vitamin-B12-Serumspiegels (Serum-Cobalamin-Spiegel). Sie ist kostengünstig, hat aber eine limitierte Spezifität und Sensitivität, besonders bei Werten < 400 ng/l.
Werte von 200 bis 1000 ng/l werden als Normwerte angegeben. Werte < 200 ng/l (< 150 pmol/l) sind sicherer Ausdruck eines Vitamin-B12-Mangels. Auch bei Werten < 400 ng/l kann bereits ein funktioneller Vitamin-B12-Mangel vorliegen. Deshalb sind bei solchen Werten weitere Untersuchungen erforderlich. Dazu gehören:
Bestimmung von Holotranscobalamin
Vitamin B12 ist im Blut überwiegend and die Proteine Transcobalamin und Haptocorrin gebunden, wobei nur der an Transcobalamin gebundene kleinere Teil (etwa 10 – 25%) biologisch verfügbar und aktiv ist [15]. Dieser Komplex von Transcobalamin und Vitamin B12 wird Holotranscobalamin (Holo-TC) genannt. Ein erniedrigter Holo-TC-Spiegel gilt als frühester Marker eines Vitamin-B12-Mangels. Werte < 35 pmol/l sprechen für einen Mangel, Werte von 35 bis 50 pmol/l sind im "Graubereich", bei > 50 pmol/l ist ein Mangel unwahrscheinlich.
Bestimmung der Methylmalonsäure
Die Methylmalonsäure (MMA) gilt als sehr empfindlicher funktioneller Indikator für einen Vitamin-B12-Mangel [11, 21]. Die MMA ist ein Stoffwechselprodukt, das zu seiner Umsetzung Vitamin B12 benötigt. Fehlt Vitamin B12, steigt die MMA-Konzentration erheblich an. Erhöhte MMA-Werte können also trotz normaler Serum-Cobalamin-Spiegel auf einen funktionellen Vitamin-B12-Mangel hinweisen [11]. MMA kann im Serum und im Urin gemessen werden. Da der MMA-Wert bei eingeschränkter Nierenfunktion ebenfalls erhöht sein kann, sollte zusätzlich der Kreatininwert bestimmt werden. Normal sind MMA-Serumspiegel von 50 bis 300 nmol/l.
Die MMA-Bestimmung ist sehr sensitiv. Sie verhilft bereits in frühen Stadien eines B12-Mangels zu einer sicheren Diagnose und ist auch zum Nachweis des Ansprechens auf die Vitamin-B12-Substitution gut geeignet. Im Unterschied zur Bestimmung der Serum-Cobalamin-Spiegel, die nur den alimentären und resorptiven Vitamin-B12-Mangel gut nachweist, ermöglicht die MMA-Bestimmung auch die Erfassung von Störungen des Vitamin-B12-Transports, der Synthese von Adenosylcobalamin und der Methylmalonyl-CoA-Mutase-Aktivität. Eine 2010 durchgeführte Round-Table-Diskussion zur Bestimmung des Vitamin-B12-Status in weiteren NHANES-Studien empfahl, den Serum-Cobalamin-Spiegel und die MMA zu messen.
Bestimmung von Homocystein
Ein weiterer indirekter funktioneller Parameter des Vitamin-B12-Status ist das Homocystein. Diese potenziell toxische Aminosäure entsteht bei der Demethylierung der essenziellen Aminosäure Methionin; zur Remethylierung von Homocystein zu Methionin ist Vitamin B12 erforderlich. Folglich reichert sich bei einem Vitamin-B12-Mangel das Homocystein an. Ein Homocystein-Serumspiegel > 10 µmol/l ist ein Hinweis auf einen möglichen Vitamin-B12-Mangel, er kann jedoch auch auf einen Mangel an Vitamin B6 und Folsäure hinweisen und ist insofern kein spezifischer Marker [28].
Die Bestimmung von MMA und Homocystein ist bei diagnostisch unklarem Vitamin-B12-Mangel zu empfehlen. Wenn diese Metaboliten im Normalbereich sind, kann ein Vitamin-B12-Mangel mit nahezu 100%iger Sicherheit ausgeschlossen werden [17].
Häufigkeit des Vitamin-B12-Mangels
Die Häufigkeit des Vitamin B12-Mangels wird in der Praxis unterschätzt. Das beruht vorrangig auf den immer wiederkehrenden Aussagen zur ausreichenden Versorgung der Bevölkerung mit Vitamin B12. Allerdings hat die Nationale Verzehrsstudie II (2008) insbesondere bei Frauen eine teilweise erhebliche Unterversorgung mit Vitamin B12 ergeben (Tab. 1) [14].
Tab. 1: Anteil der Personen, die mit der Nahrung zu wenig Vitamin B 12 aufnehmen, in verschiedenen Bevölkerungsgruppen (Nationale Verzehrsstudie II (2008) [14]) | |||||
Geschlecht |
Altersgruppe (Jahre) |
||||
19 – 24 |
25 – 34 |
35 – 50 |
51 – 64 |
65 – 80 |
|
Männer |
7,4% |
6,8% |
8,4% |
7,9% |
9,8% |
Frauen |
32,7% |
26,4% |
24,5% |
23,0% |
26,3% |
Doch nicht jede Unterversorgung bedeutet einen Mangel. Während unter Vitaminunterversorgung die Unterschreitung der Referenzwerte für die tägliche Vitaminzufuhr zu verstehen ist, setzt der Vitaminmangel voraus, dass es deswegen zu klinisch relevanten, messbaren Störungen bzw. charakteristischen Mangelsymptomen kommt. Ungeachtet dessen trägt jede Person mit einer Vitaminunterversorgung das Risiko für einen funktionellen Vitaminmangel. Zudem kann trotz Zufuhr von Vitamin B12 oberhalb der Referenzwerte ein funktioneller Vitamin-B12-Mangel bestehen [10].
Der Vitamin-B12-Mangel wird weltweit als Problem angesehen, besonders bei Älteren [1]. Teilweise betrifft er 10 bis 30% der älteren "gesunden" Personen über 65 Jahre [9].
Ursachen des Vitamin-B12-Mangels
Die Ursachen des Vitamin B12-Mangels sind vielseitig und können in vier Gruppen eingeteilt werden:
1. Ernährungsbedingter (diätetischer) Mangel durch unzureichende Aufnahme von Vitamin B12 mit der Nahrung.
2. Malabsorption (Störungen der Aufnahme von Vitamin B12) durch
– Fehlen von Intrinsic Factor oder von Parietalzellen wie bei perniziöser Anämie, atrophischer Gastritis, Postgastrektomie-Syndrom;
– Störung der Freisetzung von Vitamin B12 aus der Nahrung wegen Magensäuremangel (z. B. bei längerfristiger Einnahme von Protonenpumpenhemmern oder H2-Antagonisten),
– medikamentöse Interaktionen (z. B. mit Metformin, Nitraten).
3. Darmerkrankungen wie tropische Sprue, Morbus Crohn, Zollinger-Ellinger-Syndrom, Darmresektion, intestinaler Bypass, Imerslund-Gräsbeck-Syndrom), bakterielle Überwucherung (z. B. Campylobacter), Befall durch Fischbandwurm.
4. Störungen der Verwertung von Vitamin B12.
In der Mehrzahl der Fälle von Vitamin-B12-Mangel handelt es sich um eine Malabsorption, die bei älteren Personen überwiegend auf einer eingeschränkten Magensäureproduktion (Achlorhydrie) oder einer atrophischen Gastritis vom Typ B mit Sub- und Anazidität sowie verminderter Sekretion bzw. Produktion von Pepsinogen und Intrinsic Factor beruht; denn Salzsäure und Pepsin setzen die an Protein gebundenen Cobalamine aus der Nahrung frei (s. Textkasten). Ein Mangel an Magensäure führt zu einem höheren pH-Wert im Dünndarm, der das Wachstum von Mikroorganismen begünstigt. Clostridien und Campylobacter wandeln Vitamin B12 in unwirksame Cobalamide um und synthetisieren Substanzen, die in der Ileumschleimhaut mit Vitamin B12 um Rezeptoren konkurrieren. Die Verfügbarkeit von Vitamin B12 nimmt dadurch weiter ab. Die Atrophie der Magenschleimhaut ist häufig eine Folge der Infektion mit Helicobacter pylori, an der bis zu 60% der älteren Menschen leiden.
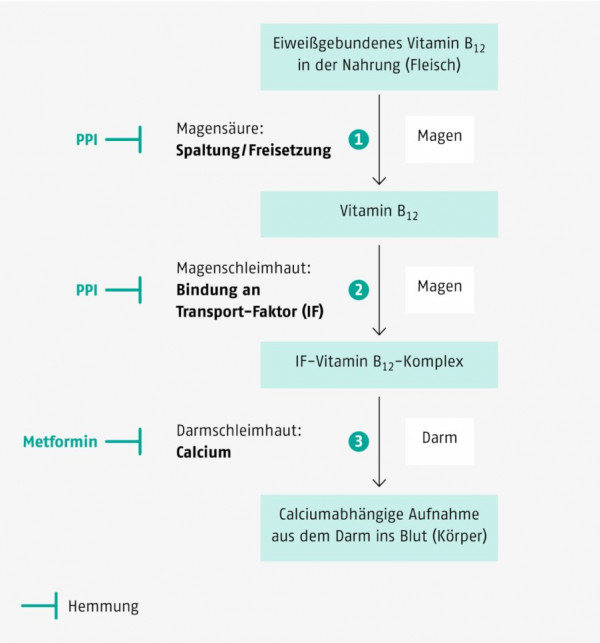
Resorption von Vitamin B12Das in der Nahrung an Proteine gebundene Cobalamin wird im Magen durch Pepsin und Salzsäure freigesetzt und an ein von den Speicheldrüsen gebildetes R-Protein gebunden. Im Duodenum wird das Cobalamin nochmals freigesetzt und pH-abhängig an den Intrinsic Factor (IF) gebunden. Der IF-Vitamin-B12-Komplex bindet dann an Cubilin, das zusammen mit einem weiteren Protein, dem Megalin, im terminalen Ileum die Calcium-abhängige, Rezeptor-vermittelte Endozytose einleitet. Die Kapazität dieses aktiven Resorptionsmechanismus liegt bei 1,5 µg Vitamin B12 pro Tag. Vitamin B12 kann zusätzlich durch passive Diffusion aufgenommen werden; allerdings beträgt hier die Resorptionsrate nur etwa 1%. |
Protonenpumpenhemmer und Vitamin B12
Auf Protonenpumpenhemmer (PPI) entfallen über 60% des Umsatzes der Magen-Darm-Mittel. Bei Patienten, die wegen peptischer Erkrankungen längere Zeit PPI (z. B. Omeprazol) einnehmen, sollte ein besonderes Augenmerk auf die Vitamin-B12-Versorgung gerichtet werden, denn PPI vermindern die Magensäuresekretion und damit die Freisetzung von Vitamin B12 aus Nahrungsmitteln (Abb. 2). Diesen Personen wird eine regelmäßige Supplementierung von wenigstens 100 µg Vitamin B12 pro Tag in Kombination mit Folsäure und Vitamin B6 empfohlen. Da der Umfang des aktiv resorbierten Vitamin B12 von der Verfügbarkeit des Intrinsic Factor (IF) abhängt, empfehlen einige Autoren zum Teil eine hohe Dosierung (z. B. 1000 µg/Tag, p. o.), damit noch geringe Mengen des Vitamins mittels passiver Resorption aufgenommen werden können [23].
Metformin und Vitamin B12
Metformin wird vor allem in der Therapie übergewichtiger Typ-2-Diabetiker eingesetzt, da es im Gegensatz zu den insulinotropen Antidiabetika in der Regel weder eine Gewichtszunahme noch hypoglykämische Attacken auslöst. In klinischen Studien wurde immer wieder beobachtet, dass es bei der Langzeittherapie mit Metformin zu einer Vitamin-B12-Malabsorption und zu einem Abfall der Vitamin-B12-Serumspiegel um bis zu 30% kommt. Metformin führt zu einer Störung der calciumabhängigen und rezeptorvermittelten Endozytose des IF-Vitamin-B12-Komplexes im terminalen Ileum (Abb. 2).
In einer Fall-Kontroll-Studie wurden 155 Diabetiker, die unter der Therapie mit Metformin einen Vitamin-B12-Mangel entwickelt hatten (durchschnittliche Vitamin-B12-Serumspiegel 148,6 ± 40,4 pg/ml [110 ± 30 pmol/l]), mit 310 Kontrollpersonen verglichen, die unter der entsprechenden Medikation keinen Mangel an Vitamin B12 aufwiesen. Dabei ergaben sich nach Angleichung möglicher Einflussfaktoren zwei statistisch signifikante Korrelationen:
Jede Steigerung der Metformindosis um 1 g/d erhöhte das Risiko für einen Vitamin-B12-Mangel um mehr als das Doppelte (Odds Ratio 2,88; 95%-Konfidenzintervall 2,15 – 3,87; p < 0,001).
Verglichen mit einer Therapiedauer unter drei Jahren war das Risiko bei einer Therapiedauer von mindestens drei Jahren ebenfalls mehr als doppelt so hoch (Odds Ratio 2,39; 95%-Konfidenzintervall 1,46 – 3,91; p = 0,001) [24].
In einer weiteren Studie an 165 Typ-2-Diabetikern wurde der Einfluss einer sechswöchigen Therapie mit Metformin bzw. Rosiglitazon auf den Vitamin-B12- und Folsäure-Status sowie auf den Homocysteinspiegel erfasst. Unter Metformin kam es zu einem Anstieg der Homocysteinspiegel um 2,36 µmol/l sowie zu einem Abfall der Folsäure- und Vitamin B12-Blutspiegel. Rosiglitazon dagegen beeinflusste die beiden Messwerte nicht [25]. Ähnliche Ergebnisse zeigten kontrollierte Interventionsstudien [26 – 27].
Risikogruppen für einen Vitamin-B12-Mangel
Zu den Risikogruppen für einen Vitamin-B12-Mangel gehören vorrangig
ältere Personen
Vegetarier und Veganer
Personen mit Magen-Darm-Erkrankungen
Personen mit einem erhöhten Bedarf an Vitamin B12 (Schwangere, Stillende, Patienten mit Autoimmunerkrankungen oder HIV-Infektion)
Personen mit langfristiger Einnahme von PPI, H2-Antagonisten oder Metformin
Patienten mit Nierenerkrankungen.
Eine Untersuchung von älteren Patienten (> 65 Jahre) mit Vitamin-B12-Mangel ergab, dass 53% eine Malabsorption und 33% eine perniziöse Anämie hatten; nur bei 2% bestand eine diätetische Ursache, und bei 11% war die Ätiologie ungeklärt [6].
Vegetarier und vor allem Veganer haben ein erhöhtes Risiko für einen Vitamin-B12-Mangel, weil tierische Nahrungsmittel die hauptsächlichen Vitamin-B12-Quellen sind. In einer Untersuchung dieser Risikogruppe hatten 63% der Lacto- und Ovolactovegetarier erhöhte Methylmalonsäure-Werte (> 271 nmol/l) und 73% erniedrigte Holo-Transcobalamin-Werte (< 35 pmol/l); unter den Veganern hatten sogar 86% erhöhte MMA-Werte und 90% erniedrigte Holo-TC-Werte [7].
Besonders risikobehaftet sind Säuglinge von Müttern mit einem Vitamin-B12-Mangel. Bei ihnen kann es zu Störungen des Wachstums und der psychomotorischen Entwicklung, zu Muskelhypotonie und Hirnatrophie kommen [12]. Deshalb sollen Schwangere und Stillende auf eine ausreichende Zufuhr von Vitamin B12 achten.
Bei einer "Cobalamin-Resistenz" kann es trotz normaler Serum-Cobalamin-Spiegel und einer ausreichenden Zufuhr an Vitamin B12 mit der Nahrung zu einem funktionellen Mangel an Vitamin B12 kommen [19]. Das ist in besonderer Weise bei älteren Personen sowie Patienten mit Nierenerkrankungen und Diabetes mellitus zu beachten.
Therapie des Vitamin-B12-Mangels
Hämatologische und neurologisch-psychiatrische Erkrankungen, die auf einem funktionellen Vitamin-B12-Mangel beruhen, sind möglichst früh durch die Substitution von Vitamin B12 zu behandeln, um irreversible Schäden zu vermeiden. Vitamin B12 wird initial parenteral appliziert (in Form von Cyanocobalamin oder Hydroxocobalamin), um eine rasche Anflutung zu erzielen, danach oral (in Form von Cyanocobalamin) [16]. Gemäß einer Bewertung durch die Cochrane Group ist oral verabreichtes Cyanocobalamin in Dosierungen von 1000 – 2000 µg, anfangs täglich und danach wöchentlich, ebenso effektiv wie die parenterale Applikation [22].
Liegt eine Malabsorption, Darmerkrankung oder Störung der Verwertung von Vitamin B12 vor, sind Dosierungen von 500 bis 2000 µg/d zu empfehlen. Eine randomisierte doppelblinde Dosisfindungsstudie mit älteren Patienten (≥ 70 Jahre; n = 120) hat Dosierungen von 2,5, 100, 250, 500 oder 1000 µg/d Cyanocobalamin über 16 Wochen getestet, mit dem Ergebnis, dass die beiden höchsten Dosen, 500 oder 1000 µg/d, zur Normalisierung der Werte (Serum-Cobalamin-Spiegel, Holo-TC, MMA und Homocystein) erforderlich waren [4].
Bei leichteren, z. B. alimentär bedingten Formen des Vitamin-B12-Mangels reichen Dosierungen von 10 bis 100 µg/d Cyanocobalamin zu einer Normalisierung der Werte aus (Tab. 2).
Tab. 2: Dosierungsempfehlungen für Vitamin B 12 | |
Personengruppe |
Dosierung |
Gesunde Erwachsene |
3 µg/d* |
Schwangere und Stillende |
3,5 bis 4,0 µg/d* |
Alimentär bedingter Mangel |
10 bis 100 µg/d |
Einnahme von PPI |
100 (bis 1000) µg/d** |
Einnahme von Metformin |
100 (bis 1000) µg/d** |
Schwere Erkrankungen |
500 bis 2000 µg/d*** |
* Laut D-A-Ch
** Empfehlenswert: Kombination mit Folsäure und Vitamin B6 *** Initial: parenterale ApplikationSteigerung der kognitiven Leistungsfähigkeit
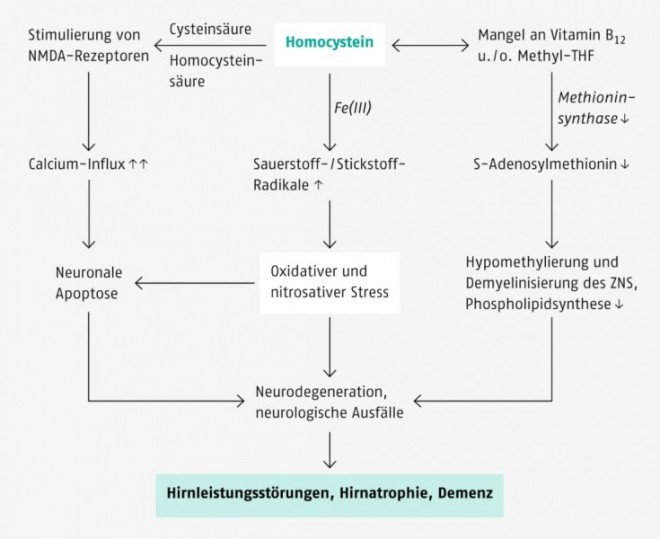
Im Intermediärstoffwechsel spielen Vitamin-B12-abhängige Methylierungsreaktionen eine zentrale Rolle (s. o.). Ein diätetischer Mangel an Vitamin B12 (oder Vitamin B6 und Folsäure) ist eine der häufigsten Ursachen für eine Hyperhomocysteinämie, die das Risiko für neuronale Schäden erhöht (Abb. 3), aber auch die Zellproliferation beeinträchtigt und Chromosomenstrangbrüche verursachen kann.
Studien zufolge sind im fortgeschrittenen Lebensalter eine latente Unterversorgung mit Vitamin B12 sowie ein erhöhter Homocystein-Plasmaspiegel (> 10 µmol/l) mit einer Abnahme der kognitiven Leistungsfähigkeit verbunden [29]. Die Varianz in kognitiven Leistungstests wird bei älteren Personen – unabhängig vom Intelligenzquotienten – zu etwa 11% auf die Homocysteinwerte zurückgeführt [30]. Auch das Auftreten von Depressionen ist im Alter häufig mit einem niedrigen Vitamin-B12-Status und erhöhten Homocysteinwerten assoziiert.
Eine Hyperhomocysteinämie gilt zudem als unabhängiger Risikofaktor für eine Demenz vom Alzheimer-Typ. In der großen Framingham-Studie war das Risiko für Morbus Alzheimer bei einem Homocysteinspiegel > 14 µmol/l nahezu verdoppelt [31]. Erhöhte Homocysteinspiegel sind bei älteren Personen mit einem kleineren Hippocampus und einer erhöhten Atrophierate des medialen Temporallappens und der weißen Substanz verbunden [32 – 34].
Eine prospektive Studie der Universität Oxford, die an 107 Personen im Alter zwischen 61 und 87 Jahren durchgeführt wurde, zeigt eine signifikante Assoziation zwischen dem Vitamin-B12-Status und der Hirngröße. Bei den gesunden Probanden wurden zu Beginn der Studie und danach jährlich kognitive Tests durchgeführt, die Hirngröße mittels Kernspintomografie gemessen und die Vitamin-B12- und die Holo-TC-Plasmaspiegel erfasst. Nach fünf Jahren war die altersbedingte Hirnatrophie bei den Probanden mit niedrigem Vitamin-B12-Status am stärksten fortgeschritten. Im Vergleich zu Studienteilnehmern mit den höchsten Vitamin-B12-Werten war die niedrigste Tertile (Vitamin B12 < 308 pmol/l, Holo-TC < 54 pmol/l) mit einem mehr als sechsfach erhöhten Risiko für den Verlust von Hirnvolumen assoziiert (Odds Ratio 6,17; 95%-Konfidenzintervall 1,25 – 30,47). Bemerkenswert ist dabei, dass die Atrophie des Gehirns bereits bei einem marginalen und nach heutiger Definition nicht manifesten Vitamin-B12-Mangel auftrat [35].
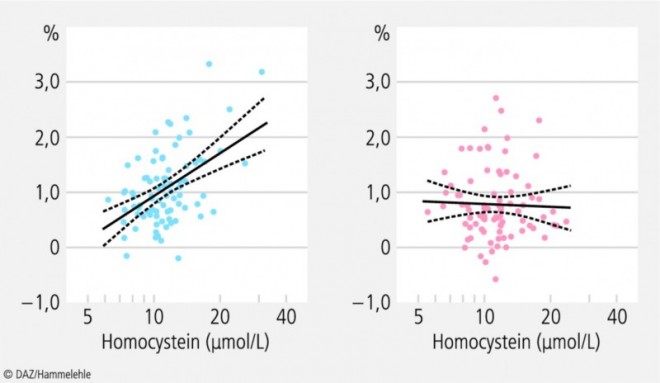
In einer randomisierten, doppelblinden Interventionsstudie (VITACOG-Studie) an 168 älteren Personen mit milder kognitiver Beeinträchtigung (Alter: ≥ 70 Jahre) konnten durch die perorale Supplementierung von Vitamin B12 (500 μg/d), Folsäure (0,8 mg/d) und Vitamin B6 (20 mg/d) über einen Zeitraum von 24 Monaten gegenüber der Placebogruppe bei den Probanden mit Homocysteinwerten > 13 μmol/l das Fortschreiten der Hirnatrophie und die Abnahme der kognitiven Leistungsfähigkeit signifikant (um 53,3%) verringert bzw. verlangsamt werden (Abb. 4) [36].
Fazit: Bei Risikogruppen substituieren
Die Häufigkeit eines Vitamin-B12-Mangels wird in der schulmedizinischen Praxis bisher zu wenig beachtet. Insbesondere ältere Personen, Ulkuspatienten mit Langzeitmedikation und Patienten mit neurologischen Störungen können von einer Vitamin-B12-Substitution profitieren. Bei älteren Personen kann die Einnahme von Vitamin B12 die kognitive Leistungsfähigkeit verbessern und das Risiko einer Hirnatrophie verringern.
Literatur
[1] Allen LH. How common is vitamin B-12 deficiency? Am J Clin Nutr 2009;89(2):693S – 696S.
[2] Dieterich M. Vitamin-B12
-Mangel und funikuläre Myelose. Nervenheilkunde 2007:26:769 – 773.
[3] Dror DK, Allen LH, Effect of vitamin B12
deficiency on neurodevelopment in infants: current knowledge and possible mechanisms. Nutr Rev 2008;66(5):250 – 255.
[4] Eussen SJ, et al. Oral cyanocobalamin supplementation in older people with vitamin B12
deficiency: a dose-finding trial. Arch Intern Med 2005;165(10):1167 – 1172.
[5] Healton EB, et al. Neurologic aspects of cobalamin deficiency. Medicine (Baltimore) 1991;70(4):229 – 245.
[6] Henoun Loukili N, et al. Cobalamin deficiency due to non-immune atrophic gastritis in elderly patients. A report of 25 cases. J Nutr Health Aging 2005;9(6):462
[7] Herrmann W, et al. Vitamin B-12 status, particularly holotranscobalamin II and methylmalonic acid concentrations, and hyperhomocysteinemia in vegetarians. Am J Clin Nutr 2003;78(1):131 – 136.
[8] Herrmann W, et al. Functional vitamin B12
deficiency and determination of holotranscobalamin in populations at risk. Clin Chem Lab Med 2003;41(11):1478 – 1488.
[9] Herrmann W, et al. The usefulness of holotranscobalamin in predicting vitamin B12 status in different clinical settings. Curr Drug Metab 2005;6(1):47 – 53.
[10] Howard JM, et al. Dietary intake of cobalamin in elderly people who have abnormal serum cobalamin, methylmalonic acid and homocysteine levels. Eur J Clin Nutr 1998;
52(8):582 – 587.
[11] Lindenbaum J, et al. Diagnosis of cobalamin deficiency: II. Relative sensitivities of serum cobalamin, methylmalonic acid, and total homocysteine concentrations. Am J Hematol 1990;34(2):99 – 107.
[12] Lücke T, et al. Mütterlicher Vitamin-B12
-Mangel: Ursache neurologischer Symptomatik im Säuglingsalter. Z Geburtshilfe Neonatol 2007;211(4):157 – 161.
[13] Metwally Y. Neurologic manifestations related to deficiency of Vitamin B12
• Eneurology (December 2009).
[14] Nationale Verzehrsstudie II (2008). www.nationale-verzehrsstudie.de.
[15] Nexo E, Hoffmann-Lucke E. Holotranscobalamin, a marker of vitamin B-12 status: analytical aspects and clinical utility. Am J Clin Nutr 2011;94(1):359S – 365S.
[16] Pietrzik K, Golly I, Loew D. Handbuch der Vitamine. Für Prophylaxe, Beratung und Therapie. Urban & Fischer, München/Jena 2008, S. 126 – 146.
[17] Savage DG, et al. Sensitivity of serum methylmalonic acid and total homocysteine determinations for diagnosing cobalamin and folate deficiencies. Am J Med 1994;96(3):
239 – 246.
[18] Sethi NK, Robilotti E, Sadan Y. Neurological manifestations of vitamin B12
deficiency. Internet J Nutr Wellness 2005;2(1):1 – 12.
[19] Solomon LR. Disorders of cobalamin (vitamin B12) metabolism: emerging concepts in pathophysiology, diagnosis and treatment. Blood Rev 2007;21(3):113 – 130.
[20] Standing Committee on the Scientific Evaluation of Dietary Reference Intakes and its Panel on Folate, Other B Vitamins, and Choline and Subcommittee on Upper Reference Levels of Nutrients; Food and Nutrition Board; Institute of Medicine. Dietary Reference Intakes for Thiamin, Riboflavin, Niacin, Vitamin B6
, Folate, Vitamin B12
, Pantothenic Acid, Biotin, and Choline. Washington, D.C. 1998
[21] Troxler H, Hersberger M, Baumgartner M. Methylmalonsäure zur Bestimmung des Vitamin B12
-Mangels. Schweiz Med Forum 2008;8(43):823 – 825.
[22] Vidal-Alaball J, et al. Oral vitamin B12
versus intramuscular vitamin B12
for vitamin B12
deficiency. Cochrane Database Syst Rev 2009;(3):CD004655.
[23] Gröber U. Arzneimittel und Mikronährstoffe. Medikationsorientierte Supplementierung. 2. Aufl., Wissenschaftliche Verlagsgesellschaft, Stuttgart 2012.
[24] Ting RZ, et al. Risk factors of vitamin B(12) deficiency in patients receiving metformin. Arch Intern Med 2006;
166(18):1975 – 1979.
[25] Sahin M, et al. Effects of metformin or rosiglitazone on serum concentrations of homocysteine, folate, and vitamin B12
in patients with type 2 diabetes mellitus. J Diabetes Complications 2007;21(2):118 – 123.
[26] de Jager J, et al. Long term treatment with metformin in patients with type 2 diabetes and risk of vitamin B-12 deficiency: randomised placebo controlled trial. BMJ 2010;
340:c2181.
[27] Kos E, et al. The Effect of Metformin Therapy on Vitamin D and B12
Levels in Patients with Diabetes Mellitus Type 2. Endocr Pract 2011;22:1 – 16.
[28] Gröber U. Folsäure zur Prophylaxe gegen Schlaganfall. Dtsch Apoth Ztg 2009;149(18):92 – 96.[29] Riggs KM, et al. Relations of vitamin B12
, vitamin B6
, folate, and homocysteine to cognitive performance in the Normative Aging Study. Am J Clin Nutr 1996;63:306 – 314.
[30] Budge M, et al. Plasma total homocysteine and cognitive performance in a volunteer elderly population. Ann NY Acad Sci 2000;903:407 – 410.
[31] Seshadri S, et al. Plasma homocysteine as a risk factor for dementia and Alzheimer’s disease. N Engl J Med 2002;
346:476 – 483.
[32] den Heijer T, et al. Homocysteine and brain atrophy on MRI of non-demented elderly. Brain 2003;126(1):170 – 175.
[33] Williams JH, et al. Minimal hippocampal width relates to plasma homocysteine in community-dwelling older people. Age Ageing 2002;31(6):440 – 444.
[34] Scott TM, et al. Homocysteine and B vitamins relate to brain volume and white-matter changes in geriatric patients with psychiatric disorders. Am J Geriatr Psychiatry 2004;12:631 – 638.
[35] Vogiatzoglou A, et al. Vitamin B12
status and rate of brain volume loss in community-dwelling elderly. Neurology 2008;71:826 – 832.
[36] Smith AD, et al. Homocysteine-lowering by B vitamins slows the rate of accelerated brain atrophy in mild cognitive impairment: a randomized controlled trial. Plos One 2010:5(9):1 – 10.
Autoren
Uwe Gröber, Apotheker, Leiter der Akademie
für Mikronährstoffmedizin, Essen,
ww.mikronaehrstoff.de
Prof. Dr. med. Joachim Schmidt,
Facharzt für Pharmakologie, Dresden

























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.